Основания – это химические вещества, которые обладают способностью принимать протоны от кислоты. В отличие от кислот, которые растворяются в воде, многие основания нерастворимы или имеют ограниченную растворимость. В таких случаях, взаимодействие основания с кислотой происходит не в растворе, а на границе двух фаз – в твердой и жидкой. Этот процесс изучает наука о неорганической химии, и является очень важным для понимания различных явлений и реакций в химии.
Примером нерастворимых оснований может служить оксиды – химические соединения, состоящие из кислорода и какого-либо металла. Некоторые оксиды, такие как оксид алюминия (Al2O3), нерастворимы в воде. Они обладают высокой температурой плавления и могут быть использованы в различных отраслях науки и техники.
Взаимодействие нерастворимых оснований с кислотами может происходить по различным механизмам. Один из них – реакция нейтрализации, при которой протоны от кислоты переходят на основание, образуя соль и воду. Такой процесс может происходить с образованием твердого вещества, если соответствующее основание нерастворимо. Например, реакция нейтрализации между оксидом кальция (CaO) и соляной кислотой (HCl) дает хлорид кальция (CaCl2) и воду (H2O).
Взаимодействие нерастворимых оснований является одной из основных тем в области неорганической химии. Понимание механизмов и примеров таких реакций позволяет углубить знания о химических процессах и их применении в различных сферах науки и техники. Нерастворимые основания широко используются в качестве катализаторов, материалов для создания новых соединений и многих других областях, что делает изучение данного вопроса актуальным и важным для практического применения.
Растворимость и нерастворимые основания:

Растворимость нерастворимых оснований зависит от многих факторов, таких как температура, концентрация раствора, химические свойства вещества и др. При этом, растворимость нерастворимых оснований может изменяться в широких пределах.
Особенности взаимодействия нерастворимых оснований с другими веществами и реакциями их превращения в растворимые соединения можно исследовать с помощью химического анализа и определенных экспериментов. Например, путем добавления к нерастворимому основанию раствора кислоты, можно получить новое соединение или осадок, что свидетельствует о реакции между этими веществами.
Таблица ниже приводит несколько примеров нерастворимых оснований и их реакций с кислотами:
| Нерастворимое основание | Реакция с кислотой |
|---|---|
| Оксид алюминия (Al2O3) | Al2O3 + 6HCl → 2AlCl3 + 3H2O |
| Гидроксид кальция (Ca(OH)2) | Ca(OH)2 + 2HCl → CaCl2 + 2H2O |
| Угольный диоксид (CO2) | CO2 + H2O → H2CO3 |
Таким образом, понимание растворимости и взаимодействия нерастворимых оснований является важным аспектом в изучении химии и может применяться в различных областях, включая синтез новых материалов, окружающую среду и медицину.
Определение и примеры нерастворимых оснований

Примерами нерастворимых оснований являются множество соединений, таких как металлические гидроксиды (например, гидроксид кальция Ca(OH)2), аммонийный хлорид (NH4Cl), гидроксид железа (III) (Fe(OH)3) и многие другие. Эти вещества обладают низкой растворимостью, и поэтому их осадки легко образуются при реакции с кислотами.
Нерастворимые основания играют важную роль в многих химических процессах, таких как образование осадков при нейтрализации кислотных растворов или осаждение ионов в коллоидных растворах. Они также используются в различных технических и промышленных процессах, например, в производстве фармацевтических препаратов и косметических средств.
Взаимодействие нерастворимых оснований с кислотами имеет особый механизм, который включает реакцию образования осадка и последующую связь ионов основания и кислоты в реакционной смеси. Это может привести к образованию новых соединений и снятию ионов с раствора.
Принципы взаимодействия нерастворимых оснований

Взаимодействие нерастворимых оснований обусловлено особенностями их строения и реакционной способности. Основания, которые не растворяются в воде, могут вступать в реакции с другими веществами при определенных условиях.
Одним из принципов взаимодействия нерастворимых оснований является образование осадков. При взаимодействии нерастворимого основания с кислотой или солью, образуются нерастворимые соединения (осадки), которые выпадают из раствора в виде твердых частиц.
Другим принципом взаимодействия нерастворимых оснований является образование комплексных соединений. Некоторые нерастворимые основания могут образовывать комплексные соединения с определенными веществами, такими как лиганды. В результате образуются стабильные комплексы, которые могут иметь разнообразные свойства и применение.
Еще одним принципом взаимодействия нерастворимых оснований является образование гидроксидов. Некоторые нерастворимые основания могут образовывать гидроксиды при контакте с водой или влажными средами. Гидроксиды могут быть использованы в различных процессах и технологиях, например, в производстве цемента или водоочистке.
Таким образом, взаимодействие нерастворимых оснований основано на различных принципах, которые определяют их химические свойства и реактивность. Изучение этих принципов позволяет более полно понять и использовать потенциал нерастворимых оснований в различных областях науки и техники.
Химический механизм образования общерастворимого осадка

Общерастворимый осадок может образовываться при взаимодействии нерастворимых оснований в растворах различных химических соединений. Этот процесс основан на химической реакции между основанием и растворителем, в результате которой образуется новое химическое вещество, не растворимое в данном растворителе.
В общем случае, образование общерастворимого осадка происходит следующим образом:
- Нерастворимое основание входит в раствор и диссоциирует на ионы.
- Ионы основания реагируют с ионами другого вещества в растворе, образуя новое не растворимое соединение.
- Образовавшийся общерастворимый осадок выпадает из раствора в виде твердого вещества.
Примером такой реакции может служить реакция образования общерастворимого осадка нерастворимых оснований металла с кислородом в водном растворе. Например, растворимое основание гидроксид натрия (NaOH) может реагировать с растворимой солью меди (II) сульфата (CuSO4) в водном растворе, образуя нерастворимый осадок гидроксида меди (II) (Cu(OH)2).
Таким образом, химический механизм образования общерастворимого осадка представляет собой стадии диссоциации основания, реакции его ионов с ионами другого вещества и выпадения образовавшегося осадка из раствора.
Кристаллическая решетка нерастворимых оснований
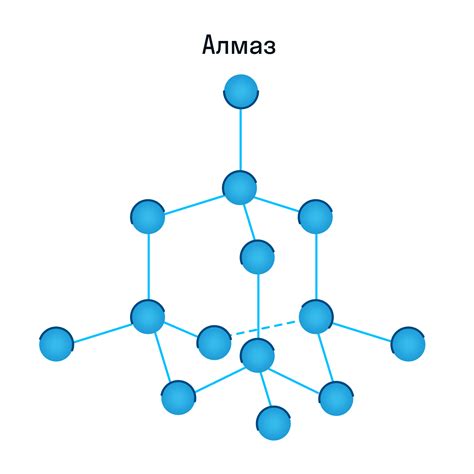
Нерастворимые основания образуют кристаллическую решетку, которая представляет собой трехмерную структуру, состоящую из атомов основания.
В кристаллической решетке нерастворимых оснований атомы расположены в определенном порядке, образуя сферические, кубические, или гексагональные клетки.
- Сферическая решетка характерна для некоторых нитратов, ацетатов и других соединений. В ней атомы основания окружены равным числом атомов других элементов.
- Кубическая решетка может встречаться у хлоридов, бромидов и других оснований. Она состоит из одинаковых кубических клеток.
- Гексагональная решетка часто наблюдается у некоторых сульфатов, карбонатов и других соединений. В ней клетки имеют форму шестиугольников.
Это упорядоченное расположение атомов в кристаллической решетке позволяет нерастворимым основаниям обладать определенными физическими свойствами, такими как жесткость, прочность или способность сохранять свою форму.
Кристаллическая решетка также определяет способность нерастворимых оснований взаимодействовать с другими веществами. Например, взаимодействие оснований с кислотами может приводить к образованию солей или осаждению нерастворимых соединений.
Растворимые и нерастворимые основания в природе

Нерастворимые основания, напротив, не растворяются в воде и не образуют полностью диссоциированных ионов гидроксида. Такие основания крайне слабо реагируют с водой и остаются в твердом состоянии или образуют нерастворимый осадок. Примерами нерастворимых оснований являются гидроксид железа(III) (Fe(OH)3), а также многие другие металлические гидроксиды.
Нерастворимые основания в природе могут играть важную роль в различных химических процессах, таких как образование осадков, превращение неорганических соединений, а также впитывание ионов из окружающей среды. Необходимо отметить, что нерастворимость оснований зависит от различных условий, включая pH среды и наличие других химических соединений.
| Растворимые основания | Нерастворимые основания |
|---|---|
| Гидроксид натрия (NaOH) | Гидроксид железа(III) (Fe(OH)3) |
| Гидроксид калия (KOH) | Гидроксид меди(II) (Cu(OH)2) |
| Гидроксид аммония (NH4OH) | Гидроксид цинка (Zn(OH)2) |
Применение нерастворимых оснований в промышленности

Нерастворимые основания играют важную роль в различных отраслях промышленности. Они используются для различных целей, таких как очистка воды, обработка металлов и производство химических соединений.
Одним из наиболее распространенных применений нерастворимых оснований является использование гидроксида кальция в процессе очистки воды. Гидроксид кальция способен нейтрализовать кислоты и превращать их в нерастворимые соли, что позволяет удалить загрязнения и соли из воды.
Еще одним важным применением нерастворимых оснований является их использование в процессе обработки металлов. Например, оксид кальция используется для удаления окислов и примесей с поверхности металлов, что позволяет улучшить их внешний вид и снизить риск коррозии.
Другой областью применения нерастворимых оснований является производство химических соединений. Например, гидроксид натрия используется в процессе производства мыла, стекла и бумаги. Он играет роль щелочи и помогает регулировать pH-уровень и химические свойства конечного продукта.
Таким образом, нерастворимые основания имеют широкое применение в промышленности и играют важную роль в различных процессах. Их способность взаимодействовать с кислотами и другими веществами делает их неотъемлемой частью многих производственных процессов.