Когда мы говорим о химических элементах, мы обычно думаем о различных свойствах, таких как внешний вид, отношение к окружающей среде или способность взаимодействовать с другими веществами. Однако, существует еще один аспект, который определяет поведение и структуру атома - это его энергетическое состояние.
Энергетическое состояние элемента определяется энергией, которая присутствует в его атоме и контролирует его поведение на молекулярном уровне. Все атомы стремятся к наиболее устойчивому и энергетически выгодному состоянию, и их поведение часто объясняется именно этим фактором. Энергетические уровни атомов можно представить как различные "этажи" на лестнице, где атомы могут находиться в различных состояниях в зависимости от количества энергии, которую они имеют.
Каждый атом имеет определенное количество энергетических уровней, но они не равномерно распределены. Более низкие уровни имеют меньшую энергию, а более высокие уровни - больше энергии. За счет этой энергетической структуры атома возникают различные свойства элементов, такие как способность готовиться к химическим реакциям или образованию химических связей с другими атомами. Кроме того, энергетические уровни позволяют атомам поглощать или испускать энергию, например, в виде света или тепла, при переходе между различными состояниями.
Структура атома: электроны и их уровни энергии
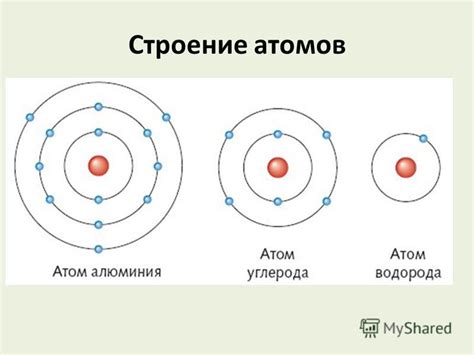
Когда мы говорим о структуре атома, мы обычно представляем себе маленький, составленный из заряженных частиц, объект. Однако масштабы атома настолько малы, что его внутренняя структура оказывается недоступной для прямого наблюдения.
Основными строительными блоками атома являются электроны, негативно заряженные частицы, которые обращаются вокруг положительно заряженного ядра. Однако не все электроны находятся на одном и том же расстоянии от ядра, а распределены по разным "уровням" энергии.
- Первый уровень энергии - наиболее близкий к ядру и наименее энергетический. На нем могут находиться до двух электронов.
- Второй и третий уровни энергии находятся на большем расстоянии от ядра и могут содержать до восьми электронов каждый.
- Четвертый, пятый и последующие уровни энергии имеют еще большую энергию и могут вместить большее количество электронов.
Важно отметить, что электроны находятся в постоянном движении вокруг ядра и могут переходить с одного уровня энергии на другой. Эти переходы сопровождаются испусканием или поглощением энергии в форме фотонов света.
Структура атома и его электроны имеют фундаментальное значение для понимания химических свойств веществ и формирования таблицы Менделеева. Изучение энергетических уровней электронов и их поведения позволяет нам понять, какие элементы взаимодействуют друг с другом и почему они образуют различные соединения и сочетания.
Связь расположения элементов в таблице Менделеева с энергетическими уровнями

В таблице Менделеева элементы расположены в определенном порядке, который имеет глубокую связь с энергетическими уровнями этих элементов. Расположение элементов в таблице отражает увеличение энергетических уровней электронов в атоме вещества.
На самом верхнем горизонте таблицы располагаются элементы с самыми низкими энергетическими уровнями. Это связано с тем, что электроны находятся на более близких к ядру энергетических уровнях и держатся крайне плотно. С другой стороны, элементы на нижнем горизонте таблицы имеют наибольшее количество энергетических уровней, что указывает на расположение электронов на более удаленных от ядра орбитах.
Помимо горизонтальных строк, таблица Менделеева также имеет вертикальные группы, которые также являются важными для понимания энергетических уровней элементов. В каждой вертикальной группе элементы имеют одинаковое число электронов на внешнем энергетическом уровне, что делает их химически сходными. Это обеспечивает определенные закономерности в химическом поведении элементов и их способность образовывать химические соединения.
Таким образом, энергетические уровни элементов, их расположение в таблице Менделеева имеют тесную взаимосвязь. Понимание этой связи помогает нам более глубоко изучать и прогнозировать химические свойства и реакции элементов, что является фундаментальным для многих научных и практических областей.
| 1 период | ... |
|---|---|
| 2 период | ... |
| 3 период | ... |
| 4 период | ... |
| 5 период | ... |
| 6 период | ... |
| 7 период | ... |
Понятие энергетических уровней и их значение в химических реакциях
В химических реакциях происходит передача энергии, и энергетические уровни играют важную роль в этом процессе. Они определяют возможность или невозможность взаимодействия атомов и молекул, а также характер и направление протекающих реакций.
На энергетических уровнях электроны могут находиться в разных состояниях – основном и возбужденных. Основное состояние соответствует наименьшей энергии, а возбужденные состояния – более высоким энергетическим уровням. Переход электрона с одного энергетического уровня на другой сопровождается поглощением или выделением энергии.
Используя понятие энергетических уровней, мы можем объяснить, почему некоторые реакции происходят легко, а другие требуют внешнего энергетического воздействия. Например, для протекания некоторых реакций необходимо преодолеть энергетический барьер, который представляет собой разницу между энергетическими уровнями реагирующих веществ. При этом, если исходные вещества находятся на более высоком энергетическом уровне, чем конечные продукты, то энергия освобождается в результате реакции.
Взаимодействие между атомами и молекулами происходит в соответствии с энергетическими уровнями, на которых находятся электроны. Изменяя энергетические уровни, мы можем контролировать химическую активность вещества и осуществлять различные химические превращения. Понимание энергетических уровней и их роли в химических реакциях является важным для разработки новых материалов, лекарственных препаратов и прогнозирования химической активности веществ.
Влияние энергетического уровня на активность химического элемента

Активность химического элемента зависит от его энергетического уровня. Этот параметр неразрывно связан с способностью элемента взаимодействовать с другими веществами и претерпевать химические реакции. От энергетического уровня зависит не только химическое поведение элемента в природе, но и его роль в различных процессах, включая биологические, промышленные и экологические.
Когда говорят о энергетическом уровне элемента, подразумевается его способность переносить и принимать энергию во время химической реакции. В зависимости от энергетического уровня, элемент может быть либо активным, либо пассивным в отношении своего окружения. Более высокий энергетический уровень позволяет элементу активно взаимодействовать с другими веществами и играть роль катализатора в различных процессах.
Энергетический уровень элемента определяется его электронной структурой. Количество энергетических уровней соответствует количеству электронных оболочек в атоме элемента. Каждый энергетический уровень имеет свойственную энергию, которая может быть измерена и использована для предсказания активности элемента в химических реакциях.
Взаимодействие элементов в реакциях основано на обмене энергией между их электронами. Элементы с близкими энергетическими уровнями могут эффективно взаимодействовать друг с другом и образовывать химические связи. Напротив, элементы с большим различием в энергетических уровнях могут иметь мало общего и не способны взаимодействовать посредством химических реакций.
Взаимодействие энергетических уровней и формирование электронных оболочек

Энергетические уровни можно представить в виде "лестницы", где каждый уровень соответствует определенной энергии. Атомы стремятся находиться в стабильном состоянии и заполнять свои энергетические уровни электронами. Более низкие уровни, ближе к ядру, имеют меньшую энергию, тогда как более высокие уровни имеют большую энергию.
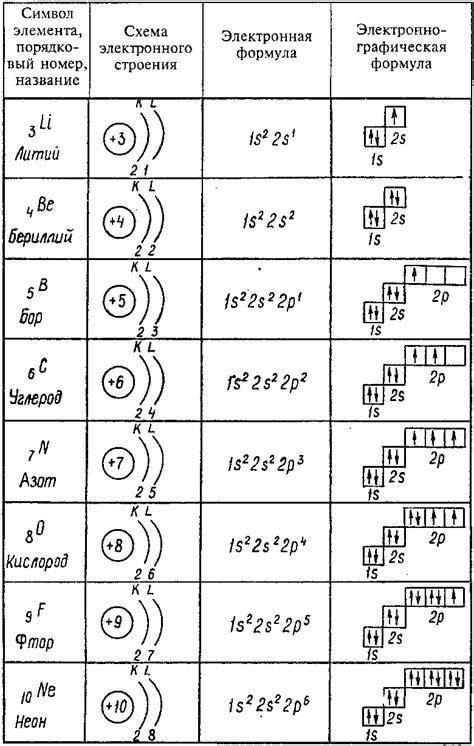
Формирование электронных оболочек происходит благодаря особому распределению электронов между энергетическими уровнями. По мере заполнения уровней электронами, образуется электронная оболочка, состоящая из нескольких подуровней. Каждый подуровень имеет свой предельное количество электронов, которые могут его заполнять. Например, внутренняя электронная оболочка (K-оболочка) может содержать до 2 электронов, а внешняя (L-оболочка) - до 8. Такая структура оболочек определяет химические свойства элементов.
Взаимодействие энергетических уровней и формирование электронных оболочек оказывает влияние на химическую активность атомов. Например, атомы, у которых внешняя оболочка содержит меньше электронов, стремятся привлечь дополнительные электроны для достижения стабильного состояния. Это приводит к образованию химических связей и образованию различных соединений.
Изучение взаимодействия энергетических уровней и формирования электронных оболочек является фундаментальным для понимания химических свойств веществ и их поведения в различных условиях. Такое знание позволяет предсказывать и объяснять реакции, а также разрабатывать новые вещества с нужными свойствами.
Вопрос-ответ

Что такое энергетический уровень в таблице Менделеева?
В таблице Менделеева энергетический уровень - это одно из основных понятий, которое помогает классифицировать элементы. Энергетический уровень - это определенная зона энергии, на которой находятся электроны атомов. В каждом уровне может содержаться определенное количество электронов. Уровни обозначаются числами от 1 до 7, причем первый уровень находится ближе к ядру, а последний - наиболее удаленный.
Какие значения энергетических уровней существуют в таблице Менделеева?
В таблице Менделеева представлены семь энергетических уровней. Первый (K) уровень находится ближе всего к ядру и может содержать максимум 2 электрона. Второй (L) и третий (M) уровни могут содержать по 8 электронов. Четвертый (N) и пятый (O) уровни могут содержать по 18 электронов. Шестой (P) уровень может содержать до 32 электронов, а седьмой (Q) уровень может содержать до 50 электронов. Кроме того, каждый уровень состоит из подуровней - s, p, d, f, которые различаются формой орбиталей и магнитными квантовыми числами.
Как энергетические уровни связаны с химическими свойствами элементов?
Энергетические уровни играют важную роль в определении химических свойств элементов. Они определяют расположение электронов в атоме и, следовательно, влияют на способность атома вступать в химические реакции. Химические свойства элемента зависят от его электронной конфигурации, то есть распределения электронов по энергетическим уровням и подуровням. К примеру, элементы с заполненными энергетическими уровнями имеют малую активность, в то время как элементы с неполностью заполненными уровнями могут образовывать химические связи и проявлять высокую реакционность.
Что такое энергетический уровень в таблице Менделеева?
Энергетический уровень в таблице Менделеева - это концепция, используемая для описания распределения электронов в атомах элементов. Каждый атом имеет энергетические уровни, на которых находятся его электроны. Уровни организованы вокруг ядра и могут содержать разное количество электронов. Первый энергетический уровень находится ближе всего к ядру и может содержать до 2 электронов, второй уровень может содержать до 8 электронов, третий - до 18 и так далее.