Розуміння хімічних реакцій та перебігу реагування речовин має зазнавати певного уточнення та розвитку. У реальному світі, де кожен процес є неперервним та становить собою складне плетіння взаємодій між частинками речовини, важливим є з'ясування принципу змін – динаміки, що відбуваються. Один з інструментів спрощеного опису реакцій полягає у використанні певних показників, що дозволяють вказати кількісну залежність між реагуючими речовинами та продуктами. Два таких показники – індекс та коефіцієнт – стають об'єктом нашої уваги.
На початку, до того як перейти до з'ясування функцій та їх призначення, необхідно коротко ознайомитися з самою сутністю, якість та призначенням цих показників. У багатьох аспектах, індекс та коефіцієнт є ключовими елементами у хімічних реакціях, що можуть видатися певною мірою складними для розуміння. Самі по собі, ці показники водночас відображають якісну та кількісну інформацію про перебіг реакцій.
Індекс в хімічній реакції є нечим іншим, як числовим індикатором, що зображує кількість атомів певних хімічних елементів, уключених у реагенти та продукти даної реакції. Величина індексу залежить від одиниць виміру, і найчастіше зображує кількість атомів конкретного хімічного елементу, які присутні у відносній молекулярній кількості речовини. Наприклад, якщо у даній реакції молекулярна кількість азоту задана як 2, то це означає, що у даній хімічній реакції принаймні 2 атома азоту взаємодіють з іншими речовинами.
Понятие и различия индекса и коэффициента в химических реакциях

Индекс в химических реакциях указывает на количество атомов каждого элемента, которое присутствует в молекуле или соединении. Он обозначается нижним индексом после символа элемента и указывает на количество атомов данного элемента. Например, водный раствор серной кислоты (H₂SO₄) содержит два атома водорода (Н) и один атом серы (S).
Коэффициент в химических реакциях, с другой стороны, указывает на количество молекул, которые участвуют в реакции. Он обозначается перед формулой соединения и отражает соотношение между различными веществами. Коэффициенты показывают пропорции, в которых реагенты превращаются в продукты реакции. Например, в уравнении реакции горения метана (CH₄ + 2О₂ → CO₂ + 2Н₂О), коэффициенты указывают, что для полного сгорания одной молекулы метана требуется две молекулы кислорода.
- Индекс - количество атомов каждого элемента в молекуле или соединении.
- Коэффициент - количество молекул, участвующих в реакции.
- Индексы указывают на состав химических соединений, тогда как коэффициенты показывают соотношение между различными веществами.
- Индексы указывают на фиксированное количество атомов элемента в молекуле, в то время как коэффициенты могут изменяться в зависимости от ситуации.
- Индексы обычно записываются в виде нижнего индекса, тогда как коэффициенты записываются перед формулой соединения.
Существенное различие между значениями индекса и коэффициента в химических уравнениях
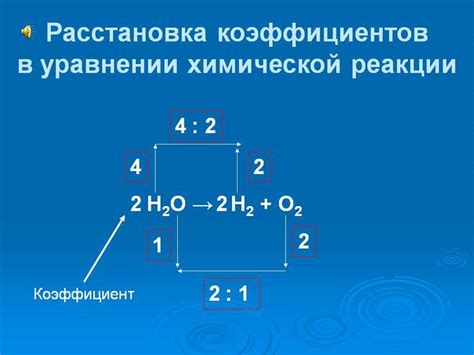
При рассмотрении химических реакций важно уяснить разницу между индексом и коэффициентом, поскольку каждая из этих величин несет значимую информацию о процессе превращения веществ. Индекс и коэффициент имеют разные назначения и участвуют в разных аспектах химических уравнений.
Когда речь идет об индексе в химических реакциях, подразумевается числовой коэффициент, который указывает на количество атомов определенного элемента в молекуле вещества. Индекс обычно записывают в виде нижнего индекса справа от символа химического элемента. Зная индексы элементов в реагентах и продуктах, можно определить, какие именно атомы участвуют в химической реакции и какие новые вещества образуются. Индексами можно оперировать при решении химических задач и анализе реакций.
С другой стороны, коэффициент в химических уравнениях представляет собой числовую величину, которая показывает отношение между молярными количествами веществ, участвующих в реакции. Коэффициенты записывают перед формулой каждого вещества в химическом уравнении. Главная цель коэффициентов - соблюдение закона сохранения массы, то есть обеспечение равенства массы реагентов и продуктов в процессе химической реакции. Коэффициент является коэффициентом пропорциональности между молярными количествами веществ.
Роль индекса в химическом уравнении: ключевые аспекты объяснения
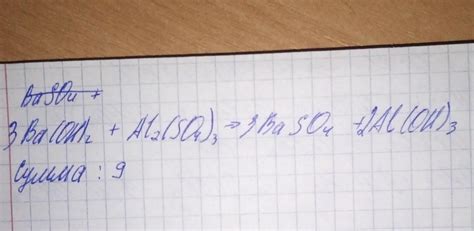
Наряду с коэффициентами, индексы являются одним из основных элементов химических уравнений, позволяющих точно описать протекающую реакцию. Относительные пропорции веществ, их соотношение и изменения под влиянием химических перетоков и превращений - все это отражается в индексах, детально раскрывая сущность происходящей реакции.
Как правило, индексы указываются после химических символов элементов, их значение может быть как положительным, так и отрицательным. Они отображают стехиометрическое соотношение элементов, позволяя установить массовые, объемные и энергетические характеристики происходящего процесса.
Индексы позволяют учёным исследовать соединения, реакции и превращения между различными веществами, а также выявлять закономерности, определяющие химические свойства элементов. Они также существенны для расчета необходимого количества реагентов и продуктов реакции.
Важно понимать, что изменение индексов в химическом уравнении изменяет его смысл и сопутствующие химические законы. Индексы являются ключевым инструментом для анализа, интерпретации и прогнозирования химических процессов, и без них невозможно достичь полного понимания механизмов реакции.
Значение коэффициента в совершенствовании пропорций химических реакций

В отличие от простого индекса, который указывает на количество атомов данного элемента в молекуле, коэффициент отражает соотношение между теми или иными веществами в реакции. Он измеряет степень, с которой различные частицы вступают в химический контакт, что позволяет определить пропорции и обеспечить гармоничный поток реакций.
Роль коэффициента в балансировке химических реакций заключается в обеспечении правильной пропорции между реагентами и продуктами. Коэффициенты позволяют согласовать количество атомов и составляющих, чтобы достичь наиболее стабильного и выгодного равновесия. Без правильной балансировки реакции будут неэффективными и несправедливыми, затрудняя искомое взаимодействие веществ и приводя к нежелательным побочным продуктам.
Понимание и применение коэффициентов в химической балансировке позволяет убедиться, что все реагенты и продукты учтены и уравновешены. Это способствует достижению оптимальных результатов с минимальными потерями, создавая основу для эффективных химических реакций.
Определение количества атомов элемента в химическом уравнении через анализ индексов
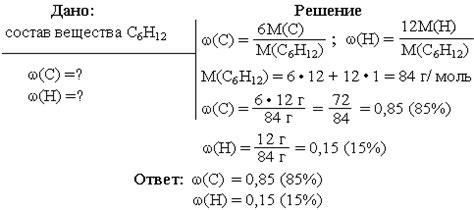
При изучении химических реакций особое внимание уделяется определению количества атомов различных элементов, присутствующих в реагентах и продуктах. Для этого используются индексы, которые указывают на количество молекул или атомов каждого элемента в уравнении реакции. Правильный анализ индексов позволяет точно определить стехиометрию химической реакции, включая количество атомов каждого элемента, участвующего в процессе превращения веществ.
Основная идея этого раздела состоит в том, чтобы рассмотреть методику определения количества атомов элемента, используя информацию, содержащуюся в индексах химического уравнения. Значения этих индексов позволяют ученому прийти к точным количественным соотношениям элементов, необходимым для проведения реакции.
Для определения количества атомов элемента в химическом уравнении необходимо анализировать соответствующие индексы. Индексы представляют собой числа, которые записываются справа от символов элементов. Положительные индексы указывают на количество атомов данного элемента в молекуле, а отрицательные - на количество молекул данного вещества. Путем анализа этих индексов можно определить, сколько атомов данного элемента присутствует в реагентах и продуктах.
Таким образом, анализ индексов в химическом уравнении позволяет определить количество атомов элемента, участвующего в реакции. Важно внимательно проанализировать индексы перед элементами, чтобы выполнить точный расчет и соблюсти стехиометрическое соотношение.
Выбор подходящего коэффициента для сбалансированного химического уравнения
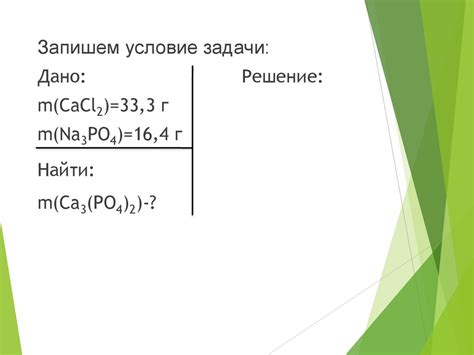
При балансировке химических уравнений, необходимо подобрать подходящие коэффициенты перед каждым веществом, чтобы обеспечить равное количество атомов каждого элемента на обеих сторонах уравнения. Это важный шаг понимания и применения химических реакций.
Коэффициенты в химическом уравнении представляют собой числа, помещаемые перед каждым веществом для выравнивания количества атомов. Они дают возможность установить соответствующие пропорции, необходимые для правильной химической реакции.
Для выбора подходящего коэффициента важно учитывать количество атомов каждого элемента до и после реакции, а также удерживать правильные пропорции между веществами. Хотя есть несколько методов балансировки уравнений, одним из наиболее распространенных является метод проб и ошибок.
Метод проб и ошибок предполагает начало с произвольного набора коэффициентов и последующую проверку, чтобы убедиться в правильности балансировки. Затем производятся корректировки, пока не будет достигнуто равенство количества атомов на обоих сторонах уравнения.
Выбор правильного коэффициента требует внимательного анализа соотношений между атомами и молекулами веществ, участвующих в реакции. Иногда могут потребоваться математические расчеты и использование химических знаний. Важно помнить, что соответствующий коэффициент должен быть натуральным числом и не может быть дробью или десятичной долей.
Примеры применения числовых показателей в химических превращениях

Перед нами открывается широкий спектр примеров, где использование индексов и коэффициентов играет ключевую роль. Рассмотрим, например, реакцию получения воды путем горения водорода. Здесь, благодаря правильной балансировке, можно определить, что необходимо две молекулы водорода (Н₂) соединить с одной молекулой кислорода (О₂), чтобы образовалась одна молекула воды (Н₂О). Используя соответствующие индексы и коэффициенты, мы можем описать эту реакцию в точных количественных терминах.
- Другим примером является реакция синтеза аммиака из азота и водорода. В данном случае, используя правильные числовые показатели, мы можем установить пропорцию между реагентами и продуктами, что позволяет контролировать процесс синтеза и получение требуемого количества аммиака.
- Интересен и пример расщепления аммиака на азот и водород. Здесь мы также можем использовать индексы и коэффициенты, чтобы определить баланс между веществами и установить соответствующие пропорции, что помогает понять процесс расщепления соединения.
- Также стоит упомянуть о реакции окисления железа, где использование индексов и коэффициентов позволяет установить соотношение между железом и кислородом, что в результате приводит к образованию оксида железа.
Это лишь несколько примеров того, как использование индексов и коэффициентов в химических реакциях помогает определить соотношения между веществами и благодаря этому обеспечить аккуратность и точность в описании и изучении химических процессов.
Роль правильного применения индексов и коэффициентов в химических уравнениях
Оптимальная балансировка химических реакций
В процессе изучения химии, важно правильно использовать индексы и коэффициенты для балансировки химических уравнений. Это является неотъемлемой частью химических расчетов и играет важную роль в определении количества реагентов и продуктов в реакции.
Соблюдение закона сохранения массы
Правильное применение индексов и коэффициентов позволяет соблюдать закон сохранения массы, который утверждает, что сумма масс реагентов должна быть равна сумме масс продуктов в химической реакции. Индексы указывают на количество атомов каждого элемента в молекуле, а коэффициенты указывают на отношение между количеством молекул реагентов и продуктов реакции.
Корректное определение стехиометрии
Использование правильных индексов и коэффициентов в химическом уравнении позволяет определить не только количество вещества, но и их соотношение в реакции. Такая информация, называемая стехиометрией, позволяет точно расчитать необходимое количество реагента для получения требуемого количества продукта.
Повышение точности и надежности результатов
Правильное использование индексов и коэффициентов в химических уравнениях существенно повышает точность и надежность экспериментов, проводимых в химической лаборатории. Неправильно сбалансированные уравнения могут привести к неверным результатам и искажению данных, что усложняет дальнейшие исследования и анализ.
Значимость обучения балансировке уравнений
Умение правильно использовать индексы и коэффициенты в химических уравнениях является не только важной компетенцией для студентов химии, но и фундаментальной основой для дальнейшего понимания химических процессов. Осознанное и ответственное применение индексов и коэффициентов позволяет снизить возможность ошибок и самостоятельно рассчитывать эффективность химической реакции.
Импортансы выбора значений коэффициентов и индексов в химических реакциях

Успешное проведение химических реакций зависит от правильного определения значений коэффициентов и индексов. Отбор конкретных значений важен для поддержания сбалансированности реакций и обеспечения эффективной химической трансформации веществ. Применение правильных значений позволяет учитывать пропорции и соотношения компонентов реакции, обеспечивая точность и надежность результатов.
1. Обеспечение сбалансированности:
Выбор правильных значений коэффициентов и индексов является важной частью процесса балансировки химических уравнений. Сбалансированное химическое уравнение показывает, что количество атомов каждого элемента на реагентной и продуктной сторонах реакции совпадает. Интерес к правильному выбору значений коэффициентов и индексов проистекает из необходимости соблюдения закона сохранения массы. В противном случае, реакция может быть неполной или невозможной.
2. Определение соотношений веществ:
Выбор значений коэффициентов и индексов также определяет соотношения между различными веществами, участвующими в реакции. Это позволяет более точно определить количество и типы веществ, требуемых или образующихся в процессе химической реакции. Эта информация играет важную роль при планировании и масштабировании производственных процессов.
3. Обеспечение эффективности реакции:
Выбор определенных значений коэффициентов и индексов также может повлиять на эффективность химической реакции. Например, правильно выбранный коэффициент может увеличить выход продукта или ускорить скорость реакции. Использование соответствующих значений позволяет учитывать энергию активации, потребляемую или выделяющуюся в ходе реакции, и оптимизировать процесс с учетом требуемых кинетических характеристик.
Как обеспечить точность результатов при использовании индексов и коэффициентов в химических уравнениях

В этом разделе мы рассмотрим важные рекомендации, которые помогут вам достичь максимальной точности при использовании индексов и коэффициентов в химических уравнениях. Правильное применение этих элементов позволяет установить соотношение между реагентами и продуктами реакции, а также предсказать и измерить количество веществ, участвующих в химической реакции.
Важно понимать, что индексы и коэффициенты необходимы для достижения баланса химического уравнения, то есть для соблюдения закона сохранения массы. Например, если в реакции участвуют две молекулы одного реагента, то его индекс будет равен 2. Правильное использование индексов позволяет корректно отобразить соотношение между веществами в уравнении.
Однако, чтобы обеспечить точность результатов, не достаточно только установить правильные индексы. Коэффициенты также играют важную роль. Их задача - выставить численное соотношение между различными реагентами и продуктами реакции. Коэффициенты позволяют учитывать количество веществ, которые участвуют в реакции, и осуществить точные расчеты по количеству веществ до и после реакции.
Для достижения точных результатов важно правильно установить соотношение между индексами и коэффициентами. Неравенство между ними может привести к неверным расчетам и ошибочным предсказаниям исхода реакции. Следует учесть, что уравнения реакций не всегда могут быть балансированы с помощью простого увеличения индексов и коэффициентов, поэтому определение правильного числа их значений является неотъемлемой частью работы с химическими уравнениями.
| Рекомендации по использованию индексов и коэффициентов: |
|---|
| Правильно определите индексы для каждого реагента и продукта реакции. |
| Тщательно выберите коэффициенты, учитывая соотношение между веществами и закон сохранения массы. |
| Очень важно соблюсти баланс химического уравнения, учитывая индексы и коэффициенты. |
| Проверьте правильность расчетов и корректность полученных результатов. |
| Не забывайте о возможности использования долевых коэффициентов в случае необходимости. |
Вопрос-ответ

Что такое индекс в химических реакциях?
Индекс в химических реакциях – это целое число, стоящее перед формулой вещества и указывающее на количество атомов данного элемента или группы атомов в химическом соединении.
Как индексы помогают описывать химические реакции?
Индексы позволяют сбалансировать химические уравнения, чтобы количество атомов каждого элемента на стороне реагентов равнялось количеству атомов на стороне продуктов. Они также помогают определить соотношение между различными веществами в химической реакции.
Что такое коэффициент в химических реакциях?
Коэффициенты в химических реакциях – это целые числа, стоящие перед формулой вещества или соединения и указывающие на количество молекул или ионов данного вещества, участвующих в реакции.
Какие задачи решаются с помощью коэффициентов в химических уравнениях?
Коэффициенты позволяют сбалансировать химические уравнения, чтобы количество атомов, молекул или ионов каждого вещества на стороне реагентов равнялось количеству на стороне продуктов. Они также помогают определить массовые или объемные соотношения между различными веществами в химической реакции.
Можно ли изменять индексы и коэффициенты в химических уравнениях по своему усмотрению?
Нет, индексы и коэффициенты в химических уравнениях следует изменять исключительно в соответствии с правилами сбалансированной реакции, чтобы сохранить массу атомов и заряд на каждой стороне уравнения. Изменение индексов или коэффициентов без необходимости может привести к неправильному описанию реакции.