Элементы химической науки предлагают захватывающий взгляд на мир атомов и молекул. В ходе своих исследований химики открывают разнообразные способы, которыми атомы соединяются, образуя сложные структуры. Одним из основных понятий в химии являются связи между атомами, которые обуславливают поведение веществ и их реакции.
Существует несколько видов связей, и каждая из них обладает своей уникальной природой и свойствами. В данной статье мы рассмотрим разницу между двумя из них - сигма и пи связями. Они отличаются друг от друга по структуре, силе и способности влиять на химические реакции.
До изучения сигма и пи связей, необходимо уяснить, что атомы образуют связи с целью достижения наиболее стабильного и энергетически выгодного состояния. В этом состоянии атомы располагаются на определенных расстояниях друг от друга, поддерживая определенные углы и направления своих связей. Благодаря этому, вещества становятся устойчивыми и могут выполнять свои функции в различных химических процессах.
Понятие связей в химических соединениях

Существует несколько типов химических связей, включая ионные, ковалентные и металлические связи. Каждый тип связи имеет свои особенности и способность формировать различные структуры. В химии также различают одинарные, двойные и тройные связи, которые характеризуются количеством электронных пар, разделяемых между атомами.
Понимание связей в химических соединениях позволяет предсказывать и объяснять их физические и химические свойства. К примеру, свойства молекул, образованных ковалентными связями, зависят от электронной структуры и расположения атомов в молекуле. Ионные связи приводят к образованию кристаллических решеток и обладают специфическими свойствами, такими как высокая температура плавления и электропроводность.
Понятие связей в химии является основой для изучения реакций, механизмов химических превращений и синтеза новых соединений. С помощью знаний о связях ученые могут предсказывать, каким будет поведение вещества в определенных условиях и разрабатывать новые материалы с желаемыми свойствами. Поэтому понимание связей в химии является неотъемлемой частью изучения данной науки.
Химические связи: Обзор
В данном разделе рассматриваются основные принципы и свойства химических связей, которые играют важную роль в синтезе и реакциях органических и неорганических соединений. Взаимодействие атомов и молекул вещества определяет его химические и физические свойства, а понимание различных типов связей позволяет предсказывать и объяснять их поведение.
Различные виды химических связей существуют в природе - от связей между атомами в последовательных молекулах ковалентных соединений до взаимодействия зарядов в ионных соединениях и слабых взаимодействий в межмолекулярных сил. Каждый вид связи имеет свои уникальные характеристики, а их понимание позволяет химикам анализировать и прогнозировать свойства и реакционную способность веществ.
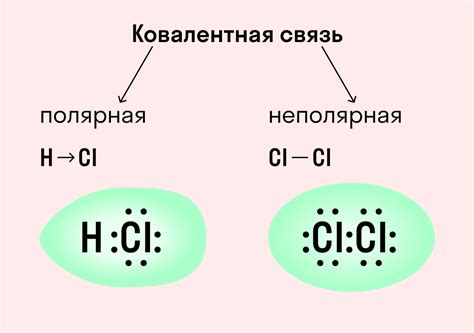
В химии существует множество терминов и понятий, связанных с химическими связями, таких как сигма и пи связи, которые играют важную роль в образовании и стабильности молекул. Сигма связи характеризуются симметричным распределением электронной плотности между ядрами атомов, в то время как пи связи образуются за счет перекрытия площадок высокой плотности электронов над и под плоскостью симметрии между атомами.
Понимание различий между сигма и пи связями помогает объяснить стабильность молекул, особенности химических реакций и физические свойства веществ. Кроме того, изучение химических связей дает возможность создавать новые соединения с заданными свойствами и изучать их возможное применение в различных областях науки и техники.
Основные виды химических связей

В химии существует несколько основных типов химических связей, которые играют важную роль во многих химических реакциях и образовании соединений. Эти связи, которые можно назвать "силами притяжения", определяют структуру вещества и его химические свойства.
Ионные связиИонные связи являются одним из наиболее распространенных типов связей в химии. В этом типе связи происходит образование электростатического притяжения между атомами, в котором один атом отдает электроны, а другой атом их принимает. В результате образуются ионы, которые притягиваются друг к другу и образуют структуру ионного соединения. | Ковалентные связиКовалентные связи возникают, когда два атома делят пару электронов, чтобы достичь наиболее стабильной электронной конфигурации. В этом типе связи атомы образуют между собой общую область электронной плотности, что обеспечивает их сопряженность и стабильность. Примерами ковалентных связей могут быть молекулярные соединения и ковалентные кристаллы. |
Металлические связиМеталлические связи характерны для металлов и характеризуются образованием "электронного моря". Атомы металла отдают свои внешние электроны, которые образуют свободно движущиеся электроны внутри структуры металла. Эти электроны обеспечивают связь между атомами и отвечают за многие особенности металлических свойств, таких как хорошая электропроводность и теплопроводность. | Водородные связиВодородные связи возникают между атомом водорода, связанным с электроотрицательным атомом, и несколькими электроотрицательными атомами. Этот тип связи сильно влияет на свойства многих веществ, таких как вода. Водородные связи обладают высокой прочностью и направленностью, что существенно влияет на структуру и свойства многих молекул и супрамолекулярных структур. |
Роль сигма и пи связей в химических реакциях

Сигма связь, также известная как одиночная связь, обеспечивает прочное соединение между атомами. Она возникает из перекрытия плоских s- и p-орбиталей атомов и характеризуется сильной направленностью электронной плотности между ядрами атомов. Это делает сигма связь очень стабильной и устойчивой к разрушениям, что делает ее часто встречающейся в органической химии. Однако, сигма связь имеет ограниченную подвижность и не способна обеспечить повороты и свободные движения молекулы.
В отличие от сигма связи, пи связь представляет собой более слабую и менее направленную связь, образующуюся при перекрытии p-орбиталей, расположенных параллельно друг другу. Это создает область электронной плотности над и под плоскостью, проходящую через ядра атомов, называемую облаком пи-электронов. Пи связи обладают большей подвижностью и способностью к ротационным движениям, что позволяет молекуле принимать различные конформации и участвовать в более сложных химических реакциях.
Различия в свойствах сигма и пи связей отражаются в их влиянии на механизмы химических реакций. Сигма связи обычно являются инициаторами и определяют начальные стадии реакции, в то время как пи связи способны перераспределяться и обусловливают изменения в геометрии и электронной структуре молекулы. Оба типа связей взаимодействуют в различных комбинациях в химических реакциях и позволяют образованию новых химических соединений и обмену энергией.
- Сигма связи обеспечивают прочность и стабильность
- Пи связи обладают подвижностью и участвуют в более сложных реакциях
- Сигма связи инициируют реакции, пи связи определяют их механизмы
Особенности Сигма связи в химических соединениях.
В мире химических соединений, существует определенный тип связи, который играет фундаментальную роль во многих химических процессах. Этот тип связи называется сигма связью. Сигма связь существует между атомами и представляет собой наиболее прочный и устойчивый вид связи. Она обладает рядом особенностей, которые делают ее важным понятием в химии.
1. Прямолинейность: Сигма связь представляет собой прямую линию, которая связывает два атома. Она формируется путем наложения орбиталей двух атомов, образуя область наибольшей плотности электронов между ними.
2. Прочность: Сигма связь является наиболее прочным типом связи в химических соединениях. Это связано с тем, что она образуется с использованием сильных сил притяжения между электронами в орбиталях атомов.
3. Одиночная, двойная и тройная связи: Сигма связь может существовать в различных степенях, образуя одиночные, двойные и тройные связи. Каждая степень связи обладает своими особенностями и химическими свойствами.
4. Влияние на физические и химические свойства: Сигма связь имеет значительное влияние на физические и химические свойства соединений. Она определяет их структуру, стабильность и реакционную способность.
5. Роль в образовании других типов связей: Сигма связь является начальной структурной единицей, которая может служить основой для образования других типов связей, таких как пи связь и металлическая связь.
В целом, сигма связь представляет собой один из основных элементов химических соединений, который играет важную роль в определении их свойств и структуры. Понимание особенностей сигма связи помогает химикам предсказывать и объяснять химические реакции и свойства различных веществ.
Структура сигма связи: понимание основного типа химической связи
Сигма-связь представляет собой тип химической связи, в которой электронные облака атомов перекрываются непосредственно между ядрами. Этот тип связи обеспечивает жесткость и прочность, позволяя молекулам сохранять свою форму и стабильность.
- Сигма-связь формируется путем перекрытия s- и p-орбиталей атомов, образуя область наибольшей электронной плотности вдоль оси связи. Это создает высокую концентрацию электронной плотности между атомами, что обеспечивает силу связи.
- Из-за прямого перекрытия электронных облаков, сигма-связи симметричны относительно оси связи и не имеют углового расположения.
- Сигма-связи обычно образуются между главными группами элементов в периодической системе, такими как углерод, кислород, азот и водород.
- Сигма-связь также может быть образована между атомами в макромолекулах, таких как полимеры, где она обеспечивает структурную целостность и устойчивость к механическим воздействиям.
В целом, структура сигма-связи является важным элементом молекулярной химии, определяя физические и химические свойства веществ. Понимание ее основных характеристик позволяет углубиться в изучение химических реакций и молекулярных структур, открывая новые возможности для применения в области материаловедения и фармацевтики.
Примеры в химических соединениях
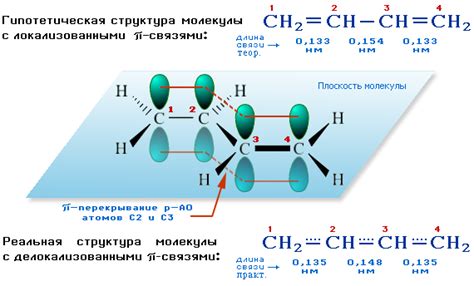
Один из примеров, где проявляются сигма и пи связи, - это алканы и алкены. В алканах связи между атомами углерода образуются исключительно с помощью сигма связей, которые обеспечивают их прямолинейное расположение и свободное вращение. В то время как в алкенах мы наблюдаем наличие пи связей, которые создают углеродные двойные связи и делают молекулы более устойчивыми и нереактивными.
Еще одним примером являются ароматические соединения, такие как бензол. В бензоле атомы углерода объединены с помощью сигма-связей, образуя шестиугольное кольцо. Кроме того, мы также видим наличие пи-связей, которые протекают в плоскости молекулы и делают ее особенно стабильной и реакционноспособной.
Еще одним интересным примером является молекула ацетилена. В ацетилене мы наблюдаем между атомами углерода наличие тройной связи, которая состоит из одной сигма-связи и двух пи-связей. Это делает ацетилен особенно реакционноспособным и используемым в различных синтетических процессах.
Пи связь: Определение и особенности

Несмотря на то, что для непрофессионала понятия "пи связь" и "сигма связь" могут показаться одинаковыми, они на самом деле имеют различные определения и особенности в химии. В данном разделе мы рассмотрим пи связь, ее основные характеристики и роль в образовании молекул.
Пи связь является одним из видов химической связи между атомами в органических и неорганических соединениях. Эта связь возникает вследствие взаимодействия пи-электронных облаков, распределенных над и под плоскостью, с другими пи-электронными облаками или атомами вещества.
Одной из важных особенностей пи связи является наличие пи-электронных облаков над и под плоскостью связанных атомов. В отличие от сигма связи, которая формируется непосредственно между двумя атомами, пи связь образуется благодаря перекрытию пи-орбиталей, представляющих электронные облака над и под плоскостью.
Пи связи являются слабее сигма связей и имеют большую длину и большую энергию. Кроме того, пи связи обладают большей подвижностью и могут вращаться вокруг оси, проходящей через плоскость связанных атомов. Это делает пи связь более гибкой и позволяет молекулам принимать различные конформации.
| Особенности | Сигма связь | Пи связь |
|---|---|---|
| Образование | Перекрытие сфер электронной плотности вдоль оси между атомами | Перекрытие пи-орбиталей над и под плоскостью связанных атомов |
| Сильность | Сильнее | Слабее |
| Длина | Короткая | Длинная |
| Подвижность | Ограничена | Большая |
Пи связи играют важную роль в химических реакциях и свойствах молекул. Они влияют на электрофильность и нуклеофильность реагентов, а также на их реакционную способность и стабильность. Кроме того, пи связи могут образовывать ароматические циклы, что делает их особенно значимыми в органической химии.
Структура пи-связи
Пи-связи образуются между атомами, когда орбитали пи-электронов находятся взаимно параллельно и перекрываются. Электроны в этих орбиталях движутся симметрично вокруг ядер, что придает связи своеобразную форму и энергетическую стабильность.
Структура пи-связи обычно представляет собой осциллирующие облака электронной плотности, которые образуются над и под плоскостью, проходящей через ядра атомов. Эти облака представляют собой максимумы и минимумы электронной плотности, которые обусловлены взаимодействием пи-электронов и пространственным распределением зарядов в молекуле.
Структура пи-связи играет важную роль в определении химических свойств молекул. Она может влиять на их энергетические уровни, стабильность и степень реакционной активности. Кроме того, структура пи-связи оказывает влияние на межмолекулярные взаимодействия, такие как ван-дер-ваальсовы силы и дисперсионные силы, что важно при изучении физических и химических свойств веществ.
| Особенности пи-связи | Роль в химических реакциях |
|---|---|
| Перекрытие пи-орбиталей | Участвует в электрофильных или нуклеофильных атаках |
| Образует два облака электронной плотности | Может быть разрывана или формироваться в процессе химических реакций |
| Способствует конъюгации в молекуле | Оказывает влияние на клеточные процессы и биологическую активность |
Примеры в химических соединениях

В данном разделе осветим конкретные примеры химических соединений, которые прояснят различия между сигма и пи связями. Возьмем в рассмотрение разнообразные вещества и соединения, чтобы продемонстрировать, как эти типы связей влияют на их структуру и свойства.
1. Бензол (C6H6)
Бензол является примером химического соединения, в котором преобладают пи связи. Шестиатомное кольцо атмосферы бензола образовано спайкой пи-орбиталей, создавая плоскую и ароматическую молекулу. Пи связи в бензоле обеспечивают его устойчивость и реакционную активность.
2. Этан (C2H6)
Этан - пример химического соединения, в котором преобладают сигма связи. Молекула этана состоит из двух атомов углерода, соединенных одиночной связью с атомами водорода. Сигма связи в этане обеспечивают его структурную стабильность и способствуют формированию трехмерной формы молекулы.
3. Этилен (C2H4)
Этилен - интересный пример химического соединения, в котором существуют как сигма, так и пи связи. Молекула этилена состоит из двух атомов углерода и четырех атомов водорода. Между атомами углерода существует двойная связь - пи связь, которая обеспечивает молекуле этилена плоскую структуру и конъюгацию электронных систем. Сигма связи между атомами углерода и водорода придают молекуле структурную устойчивость.
Эти примеры дают нам возможность лучше понять различия между сигма и пи связями в химических соединениях. Важно отметить, что это только некоторые из многообразия соединений, которые могут обладать разными типами связей. В последующих разделах мы рассмотрим более подробные аспекты этих связей и их влияния на химические реакции и свойства веществ.
Сравнение сигма и пи связей
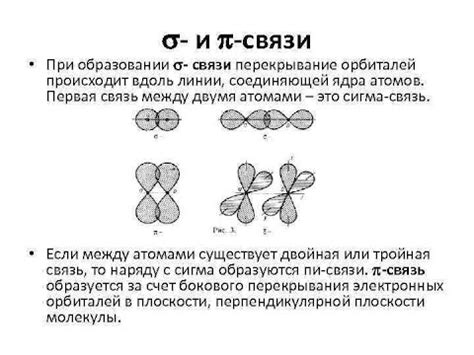
- Сигма связи: эти связи образуются путем перекрытия или наложения орбиталей атомов между атомными ядрами. Сигма связи характеризуются прямым направлением перекрытия орбиталей и являются наиболее стабильными связями в молекуле.
- Пи связи: эти связи образуются путем перекрытия или наложения боковых плоских орбиталей атомов. Пи связи образуются параллельным перекрытием электронных облаков и характеризуются узкой зоной наибольшей электронной плотности между атомами.
- Сравнение: сигма и пи связи отличаются как направленностью перекрытия орбиталей, так и формой образуемых связей. Сигма связи имеют более сильную связь и обычно образуются первыми при образовании молекулы, в то время как пи связи формируются вторыми и могут быть слабее и более подвижными.
Понимание различий между сигма и пи связями помогает химикам лучше понимать молекулярную структуру и свойства вещества, а также применять эту информацию в различных химических реакциях и процессах.
Вопрос-ответ

Какую роль играют сигма и пи связи в химии?
Сигма и пи связи - это два основных типа химических связей, которые определяют свойства и реакционную способность молекул. Сигма связи формируются из наложения простых или гибридизованных орбиталей атомов, что позволяет им разделить электроны и образовать сильную связь. Пи связи возникают из наложения необрабатываемых орбиталей, которые находятся над и под плоскостью молекулы. Эти связи менее сильны, но всё же играют важную роль в определении геометрии и свойств молекул.
В чем принципиальная разница между сигма и пи связями?
Главная разница между сигма и пи связями заключается в способе наложения орбиталей. Сигма связи формируются в результате перекрытия орбиталей двух атомов в продольной оси между ними, образуя бонд. Пи связи возникают, когда две незанятые плоские орбитали перекрываются параллельно друг другу, что приводит к формированию бонда над и под плоскостью молекулы.
Какие свойства молекул определяются сигма и пи связями?
Сигма и пи связи играют ключевую роль в определении молекулярной геометрии, стабильности и реакционных свойств молекул. Сигма связи обеспечивают сильное соединение между атомами и влияют на энергию связи, длину и угол между атомами. Пи связи, в свою очередь, определяют структуры сопряженных систем и конъюгацию, влияющую на спектральные свойства молекул и их реакционную активность.