В химии каждый элемент обладает своей уникальной характеристикой, которая определяет его поведение и взаимодействие с другими веществами. Одной из таких характеристик является электроотрицательность. Она описывает способность атома притягивать к себе электроны в химической связи и влияет на свойства вещества в целом. Сравнивая электроотрицательность двух элементов, алюминия и углерода, можно отметить удивительную особенность, связанную с их различными химическими свойствами.
Внимание привлекает то, что у алюминия электроотрицательность значительно ниже по сравнению с углеродом. Это означает, что атом алюминия имеет меньшую способность принимать на себя электроны, чем атом углерода. В связи с этими различиями, эти два элемента проявляют себя по-разному в химических реакциях и имеют разные свойства. Разница в электроотрицательности играет важную роль в образовании и стабильности химических соединений, в которых установлены разные типы связей.
Следует отметить, что более низкая электроотрицательность алюминия не делает его менее важным или менее интересным элементом. Напротив, алюминий является одним из самых распространенных элементов на Земле и играет важную роль во многих областях, включая строительство, авиацию, упаковку и медицину. Изучение различий в электроотрицательности между разными элементами помогает нам лучше понять их уникальные свойства и применения в разных сферах жизни.
Значение электронегативности в химических реакциях

Электронегативность играет важную роль в определении химической реакционной способности атомов. Она влияет на распределение электронной плотности в молекуле и может приводить к образованию положительно или отрицательно заряженных ионов.
Значение электронегативности определяется различными факторами, включая атомный радиус, ядроэлектронное взаимодействие и другие химические свойства. Часто значение электронегативности сравнивают относительно других атомов, чтобы определить, как сильно он притягивает электроны в сравнении с другими элементами.
Разница в электронегативности между атомами определяет тип химической связи, которая образуется между ними. Если разница в электронегативности между атомами невелика или отсутствует, они могут образовывать неполярную ковалентную связь. В противном случае, при большой разнице в электронегативности, образуется полярная ковалентная связь или ионная связь.
Таким образом, электронегативность играет решающую роль в химических реакциях и определяет различные химические свойства элементов. Понимание значения электронегативности помогает предсказывать поведение элементов в химических соединениях и позволяет выявить различия между атомами в разных химических системах.
Определение и суть понятия "электроотрицательность"

В химии существует понятие "электроотрицательность", которое играет важную роль при анализе и объяснении свойств различных химических элементов. Электроотрицательность характеризует способность атома притягивать к себе электроны в химической связи. Она определяется разницей электроотрицательностей элементов, входящих в химическую связь.
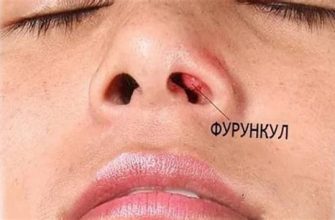
Данный параметр важен при исследовании свойств элементов и их соединений, так как он оказывает влияние на химическую активность атомов в соединениях и на свойства указанных соединений. Ниже приведены две шкалы электроотрицательности – Полинга и Малленса, которые используются для количественной оценки этого параметра.
- Шкала электроотрицательности Малленса: позволяет присвоить каждому химическому элементу определенное значение электроотрицательности, основываясь на его положении в периодической системе элементов. Чем выше значение электроотрицательности, тем сильнее элемент притягивает к себе электроны в химической связи.
- Шкала электроотрицательности Полинга: предполагает более точные количественные значения электроотрицательности элементов, которые могут быть использованы для расчетов. На основе этой шкалы можно определить разность величин электроотрицательности элементов, что имеет важное значение при объяснении различных свойств химических соединений.
Понятие "электроотрицательности" представляет собой важный инструмент для объяснения свойств химических элементов и соединений, помогает понять природу химических связей и их устойчивость.
Роль электроотрицательности в химических связях

| Свойство | Роль электроотрицательности |
|---|---|
| Полярность связи | Атомы с большей электроотрицательностью притягивают электроны связи ближе к себе, создавая полярную связь с разделением зарядов. |
| Полярность молекулы | Электроотрицательность атомов влияет на общую полярность молекулы, где различные заряды накапливаются в разных частях молекулы. |
| Сопротивление ионизации | Электроотрицательные элементы имеют большую склонность к отрыву электронов и образованию ионов в реакциях. |
| Направленность реакций | Уравновешенность электроотрицательностей элементов влияет на направленность химических реакций и степень образования новых соединений. |
Таким образом, электроотрицательность играет существенную роль в химических связях, определяя их характер и свойства соединений. Понимание электроотрицательности позволяет предсказывать химические реакции, свойства веществ и их взаимодействия в различных условиях.
Отличительные черты электроотрицательности у алюминия и углерода

В химии существуют различные методы определения электроотрицательности элементов. Используя эти методы, ученые могут сравнить электроотрицательность различных элементов и выявить их отличительные черты.
Один из таких элементов - алюминий. Это химический элемент с символом Al и атомным номером 13. Алюминий известен своей высокой проводимостью, прочностью и легкостью.
Однако, когда речь заходит об электроотрицательности, алюминий отличается от других элементов, например, углерода.
Углерод, химический элемент с символом C и атомным номером 6, также известен своей многообразной активностью и наличием различных аллотропных форм.
В данном разделе мы рассмотрим особенности электроотрицательности алюминия и углерода, их влияние на химические свойства и значимость для различных процессов.
Особенности электроотрицательности алюминия
Алюминий обладает относительно низкой электроотрицательностью, что означает его меньшую способность захватывать электроны в химических связях по сравнению с другими элементами, включая углерод. Это свойство делает алюминий хорошим проводником тепла и электричества, а также позволяет ему образовывать стабильные и прочные связи с другими элементами.
Вместе с тем, низкая электроотрицательность алюминия приводит к тому, что он обладает относительно небольшой способностью образовывать растворы с водой и другими полярными растворителями. Это приводит к тому, что алюминий обычно образует оксидационную пленку на своей поверхности, которая защищает его от дальнейшего окисления и коррозии.
Таким образом, электроотрицательность алюминия влияет на его химические свойства и способность вступать в различные реакции. Понимание этих особенностей позволяет использовать алюминий в широком спектре промышленных и научных областей, а также облегчает его включение в различные соединения и структуры, где его уникальные свойства находят применение.
Значимость электроотрицательности углерода

Важность электроотрицательности углерода состоит в его способности привлекать электроны в химической связи. Эта химическая свойство определяет его способность образовывать различные соединения и оказывать влияние на их физические и химические свойства. Благодаря своей высокой электроотрицательности, углерод может образовывать ковалентные связи с другими элементами, создавая разнообразие органических соединений, включая жизненно важные молекулы, такие как углеводороды, белки и ДНК.
Кроме того, электроотрицательность углерода также определяет его способность привлекать электроны, когда между атомами углерода и другими элементами имеются полярные связи. Это в свою очередь влияет на распределение электронной плотности в молекуле и может быть ответственным за ее физические и химические свойства. Используя свою электроотрицательность, углерод может образовывать стабильные и сложные молекулярные структуры, необходимые для поддержания жизненных процессов.
Причины различия электроотрицательности алюминия и углерода

Торгуя своими электронами на валентной оболочке, алюминий и углерод отличаются друг от друга величиной своей электроотрицательности. Это свойство, характеризующее способность атома притягивать электроны, влияет на различные аспекты химических взаимодействий и обладает особым значением в химии элементов.
Амперная система электроотрицательности позволяет оценить, насколько сильно атомы элементов притягивают электроны к себе в химических реакциях. В случае алюминия, этот параметр является относительно низким по сравнению с углеродом. Отсюда можно предположить, что алюминий находится на нижнем положительном экстремуме электроотрицательности в периоде, в то время как углерод находится на верхнем отрицательном экстремуме.
Это различие в электроотрицательности обусловлено своеобразной внутренней структурой электронного облака в атомах алюминия и углерода. У алюминия число электронов в валентной оболочке составляет N1, в то время как углерод имеет число электронов N2. Эти различия в числе электронов на внешней оболочке приводят к разным электроотрицательностям элементов.
Следует отметить, что электроотрицательность атомов является характеристикой, не зависящей только от числа электронов в оболочке, но и от других факторов, включая электронную конфигурацию атома и его электронную орбиталь. В связи с этим, алюминий и углерод имеют разную электроотрицательность, что проявляется в их разной способности притягивать электроны в химических реакциях.
Взаимосвязь строения атома и его вклада в электроотрицательность

Атом состоит из нейтрального ядра и облака электронов, расположенного вокруг него. Каждый электрон обладает определенным энергетическим уровнем и занимает свое область внешней электронной оболочки. Именно электроны во внешней оболочке играют ключевую роль во взаимодействии атомов и формировании химических связей.
Различные факторы, такие как количество электронов во внешней оболочке атома, размер атома и его строение, оказывают влияние на электроотрицательность элемента. Чем больше атом имеет электронов во внешней оболочке и чем более компактным является его строение, тем большую способность он имеет притягивать электроны. В то же время, меньшее число электронов и более разреженное строение атома уменьшает его электроотрицательность.
Таким образом, в контексте алюминия и углерода, алюминий обладает меньшей электроотрицательностью, поскольку его атом содержит меньшее количество электронов во внешней оболочке и обладает более разреженным строением по сравнению с атомом углерода. Это различие в строении атомов отражается на их химических свойствах и способности притягивать электроны во время химических реакций.
Взаимодействие атомов с окружающими электронными облаками
Электроотрицательность - это количественная мера способности атома притягивать электроны к себе в химической связи. Различия в электроотрицательности между атомами приводят к возникновению полярных связей и различных химических свойств веществ.
Определенные элементы, такие как углерод и алюминий, имеют различную электроотрицательность, что влияет на их взаимодействие с окружающими электронными облаками.
Атомы с меньшей электроотрицательностью, такие как алюминий, проявляют тенденцию отдавать электроны другим атомам, формируя ионные связи или ковалентные связи с атомами, имеющими большую электроотрицательность.
Взаимодействие электронных облаков в химической связи определяет структуру и свойства соединений. Полярность, положение электронов и их общая конфигурация играют важную роль в формировании химических соединений и определяют их физические и химические свойства.
Понимание взаимодействия атомов с окружающими электронными облаками является ключевым фактором для понимания химических реакций и различных типов связей между элементами.
Влияние различия в электроотрицательности на химические свойства

Дифференцированная электроотрицательность разных химических элементов оказывает значительное влияние на их химические свойства. Проявление этого влияния наблюдается в различных реакциях и взаимодействиях, в которых участвуют эти элементы.
Одним из ключевых факторов, определяющих химическую активность, является градиент электроотрицательности между элементами, участвующими в химической реакции. Большая разница в электроотрицательности приводит к образованию полярных связей, что обычно приводит к более ярко выраженной реакционной активности.
Взаимодействие химических элементов с различной электроотрицательностью может также влиять на степень полюсности молекулы или соединения. Элементы с более высокой электроотрицательностью могут проявлять себя как электроны сгствительные, привлекая электроны от элементов с более низкой электроотрицательностью. Это может приводить к образованию ионов и изменению свойств соединений.
Понимание влияния разницы электроотрицательности на химические свойства элементов способствует более глубокому анализу и объяснению химических реакций и взаимодействий, а также позволяет предсказывать свойства и поведение химических соединений. Это является основой для разработки новых материалов и технологий, а также для улучшения существующих процессов и продуктов.
Вопрос-ответ

Почему у алюминия меньшая электроотрицательность по сравнению с углеродом?
Алюминий имеет меньшую электроотрицательность по сравнению с углеродом из-за различий в их атомной структуре и расположении электронов в электронных оболочках. У атома алюминия 13 электронов и электронная конфигурация [Ne] 3s2 3p1, в то время как у атома углерода 6 электронов и электронная конфигурация [He] 2s2 2p2. Из-за наличия валентной электронной оболочки с одним электроном побольше, атом алюминия имеет меньшую способность притягивать электроны к себе, чем атом углерода.
Какая электроотрицательность у углерода и алюминия?
Электроотрицательность - это способность атома притягивать электроны к себе в химической связи. Углерод имеет электроотрицательность 2,55 по шкале Полинга, а у алюминия электроотрицательность составляет 1,61. Таким образом, углерод обладает большей электроотрицательностью по сравнению с алюминием.
Влияет ли электроотрицательность на физические свойства алюминия и углерода?
Да, электроотрицательность влияет на физические свойства алюминия и углерода. Электроотрицательность определяет химическую реактивность элемента, его способность вступать в химические связи и образовывать соединения. Углерод, с более высокой электроотрицательностью, имеет большую склонность образовывать связи с другими элементами и образовывать разнообразные соединения. Алюминий, с меньшей электроотрицательностью, обычно образует ионные соединения и проявляет свойства металла, такие как хорошая электропроводность и хорошая теплопроводность.
Почему углерод имеет большую электроотрицательность по сравнению с алюминием?
Углерод имеет большую электроотрицательность по сравнению с алюминием из-за своей атомной структуры. В углеродных атомах электроны более плотно распределены и сильнее притягиваются к ядру атома, что делает углерод более электроотрицательным.
Какая взаимосвязь между электроотрицательностью и восприимчивостью атомов к привлечению электронной пары?
Электроотрицательность атома характеризует его способность притягивать электронные пары к себе при образовании химических связей. Атомы с большей электроотрицательностью имеют большую восприимчивость к привлечению электронной пары, в то время как атомы с меньшей электроотрицательностью менее привлекательны для электронов.
Как электроотрицательность алюминия и углерода влияет на их химическую активность?
Более электроотрицательные элементы, такие как углерод, проявляют большую химическую активность. Это связано с их способностью привлекать электроны от других элементов и образовывать химические связи. Алюминий, имея меньшую электроотрицательность, обычно проявляет ниже химическую активность по сравнению с углеродом.