Иногда в химии возникает необходимость определить массу раствора, используя только информацию о его массовой доле и плотности. Этот метод позволяет получить точные результаты, не требуя сложных экспериментов или специального оборудования.
Массовая доля - это отношение массы растворенного вещества к общей массе раствора. Она является показателем концентрации вещества в растворе и измеряется в процентах или долях единицы. Плотность, с другой стороны, указывает на массу раствора, содержащегося в единице объема. Она зависит от химической природы вещества и его концентрации.
Используя известные значения массовой доли и плотности раствора, можно определить массу самого раствора, а не отдельных компонентов. Это основано на идеальной модели, где объем раствора можно считать равным сумме объемов растворенного вещества и растворителя, и массовая доля является пропорцией массы растворенного вещества к общей массе раствора.
Роль массовой доли в химии: путь к пониманию состава вещества

В простых словах, массовая доля отображает соотношение масс определенного вещества к общей массе системы. Благодаря этому параметру ученые могут получить информацию о процентах содержания элементов в различных веществах. Используя разнообразные методы и инструменты, химики могут точно определить массовые доли и, как следствие, состав вещества.
Для успешного решения химических задач, связанных с определением массовой доли, необходимо знать дополнительные показатели, такие как плотность. Плотность – это характеристика вещества, которая позволяет определить соотношение массы и объема. В комбинации с массовой долей, плотность позволяет определить массу вещества, его концентрацию или количество в растворе. Таким образом, массовая доля и плотность являются взаимосвязанными параметрами, которые позволяют получить ценную информацию о химическом составе вещества.
Понятие плотности и ее значение в химических расчетах
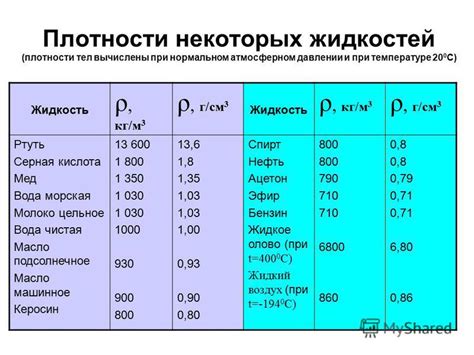
В химии, плотность играет важную роль во многих расчетах и определениях. Плотность вещества определяется как отношение массы данного вещества к его объему. Это физическая величина, которая позволяет оценить, насколько плотно упакованы молекулы вещества и как тяжелое оно будет в данном объеме. Знание плотности позволяет проводить ряд расчетов и применять ее в разных химических процессах.
Понимание плотности помогает определить, какое количество данного вещества содержится в определенном объеме или массе. Она используется для измерения концентрации растворов и позволяет определить, насколько один раствор отличается от другого. Плотность также важна при определении плотности растворителя и дополнительных компонентов в растворах.
Знание значения плотности позволяет предсказать физические свойства вещества, такие как его плавление, кипение или растворимость в других веществах. Плотность также может быть использована для определения состава неизвестного вещества, основываясь на его плотности и известных данных о плотности аналогичных веществ.
- Плотность вещества позволяет проводить расчеты и получать количественные данные о различных процессах и реакциях.
- Знание плотности раствора позволяет определить его концентрацию и осуществлять дозирование приготовления растворов.
- Плотность служит индикатором физических свойств и поведения вещества при нагревании или охлаждении.
- Плотность может быть использована для идентификации и анализа состава неизвестных веществ или примесей в растворах.
Особенности вычисления массы раствора при заданной концентрации и плотности

В данном разделе будет рассмотрена методика определения массы раствора на основе известных значений массовой концентрации и плотности. Будут представлены ключевые особенности расчета, которые позволят получить точные и надежные результаты.
Прежде чем перейти к особенностям расчета, рассмотрим общую идею этого процесса. При расчете массы раствора необходимо учесть два основных параметра - его массовую концентрацию и плотность. Массовая концентрация определяет количество растворенного вещества в единице объема раствора, а плотность определяет массу раствора в единице его объема.
Определение массы раствора при заданных значениях массовой концентрации и плотности требует учета специфики каждого параметра. Массовая концентрация может быть выражена в процентах или в г/мл. В зависимости от ее представления, формулы для расчета будут незначительно отличаться.
С учетом плотности, расчет массы раствора также требует умения преобразовывать единицы измерения, например, переводить г в мл или наоборот. Более того, необходимо знать плотность самого раствора, а не только растворенного вещества, так как это может существенно влиять на итоговый результат.
Учтя перечисленные особенности, точно определить массу раствора становится проще. Для каждой ситуации существует соответствующая формула, позволяющая провести расчет. Грамотное применение формул и понимание особенностей каждого параметра значительно повышает точность и надежность получаемых результатов.
Вычисление массы раствора: шаги для определения величины смеси и концентрации
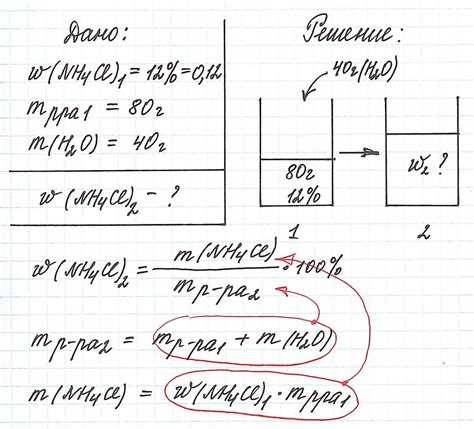
Как известно, при работе с растворами важно уметь вычислять их массу на основе заданных параметров, таких как массовая доля и плотность. В данном разделе мы представим вам пошаговую инструкцию для определения массы раствора, используя известные значения массовой доли соли или вещества в растворе и его плотности.
Шаг 1: Понимание массовой доли и ее значения.
Шаг 2: Определение плотности раствора и ее единицы измерения.
Шаг 3: Использование формулы для нахождения массы раствора.
Шаг 4: Примеры вычислений массы раствора с использованием известных значений.
Шаг 5: Проверка правильности результата и его округление до необходимой точности.
Шаг 6: Общие рекомендации и советы по выполнению вычислений массы раствора.
Следуя этим шагам, вы сможете точно определить массу раствора на основе его массовой доли и плотности, что будет полезно в различных областях науки и промышленности.
Примеры практических расчетов: определение массы раствора
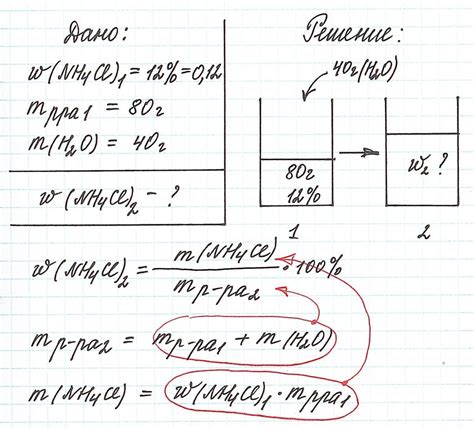
В данном разделе мы рассмотрим конкретные примеры расчетов массы раствора на практике, используя информацию о массовой доле и плотности вещества. Эти расчеты позволяют определить необходимое количество раствора для проведения экспериментов, производства или других задач.
Рассмотрим первый пример расчета. Допустим, нам необходимо приготовить раствор с определенной концентрацией соли. Известно, что массовая доля соли в этом растворе составляет 10%. Также нам известна плотность этого раствора, которая равна 1,2 г/мл. Наша задача - определить массу раствора, которую необходимо приготовить.
Для решения этой задачи мы можем использовать формулу, связывающую массу раствора, его плотность и объем:
Масса раствора = Плотность × Объем раствора
В нашем случае мы знаем плотность раствора, нам нужно определить объем раствора, который мы должны приготовить. Для этого мы можем воспользоваться формулой:
Объем раствора = Масса вещества ÷ Массовая доля
Теперь, когда мы знаем объем раствора, мы можем легко определить его массу, умножив плотность на объем. Таким образом, мы получаем искомую массу раствора.
Рассмотрим второй пример. Предположим, мы хотим приготовить раствор с определенной концентрацией кислоты. Массовая доля кислоты в этом растворе составляет 25%, а плотность раствора равна 1,4 г/мл. Наша задача - определить массу раствора, необходимую для данного эксперимента.
Аналогично первому примеру, мы можем использовать формулу для определения объема раствора:
Объем раствора = Масса вещества ÷ Массовая доля
Затем, зная объем раствора, мы можем рассчитать его массу, умножив плотность на объем.
Это лишь два примера из множества задач, которые можно решить с помощью знания массовой доли и плотности вещества. Расчеты массы раствора не только необходимы в научных и промышленных областях, но также могут быть полезными в повседневной жизни, например, при приготовлении растворов для удобрения или изготовления косметических средств. Важно уметь правильно проводить такие расчеты с использованием доступной информации.
Важность точности измерений и учет систематической погрешности

Точность измерений имеет огромное значение в различных научных областях, начиная от химии и физики, и заканчивая биологией и медициной. Верность полученных данных существенна для корректного анализа и интерпретации результатов исследования, а также для принятия конкретных научных или практических решений.
Однако, помимо случайных погрешностей, существует также систематическая погрешность, которая может привести к искажению результатов эксперимента. Происхождение систематической погрешности связано с неправильными условиями проведения измерений, ошибками в методике или с качеством используемых инструментов.
Важно отметить, что систематическая погрешность не устраняется увеличением числа измерений, в отличие от случайных погрешностей, которые могут быть уменьшены. Более того, систематическая погрешность может сохраняться на протяжении всего исследования, повлияв на все полученные результаты.
- Для избежания систематической погрешности необходимо проводить калибровку используемых инструментов и контролировать условия проведения эксперимента.
- При выборе методики измерений следует учитывать возможные систематические погрешности, связанные с этой методикой.
- Оценка систематической погрешности и реализация мер по её учету позволяют повысить достоверность и точность получаемых результатов.
Преимущества использования массовой доли и плотности в химических расчетах

Одним из преимуществ массовой доли является ее относительность: она выражает долю массы определенного вещества в общей массе раствора. Это позволяет производить сравнения и анализировать изменения концентрации раствора. Например, можно определить, какой процент массы соли содержится в растворе, и сравнить это со значением в других растворах. Также массовая доля облегчает проведение химических расчетов, поскольку она позволяет устанавливать соотношение компонентов раствора и определять необходимые объемы и массы для получения требуемой концентрации.
Плотность является также важным параметром при расчете массы раствора, поскольку она показывает, какая масса вещества содержится в единице объема. Это позволяет определить массу раствора, зная его объем. Кроме того, плотность позволяет оценивать степень насыщенности раствора и определять его плотность в зависимости от изменений температуры и давления. Таким образом, плотность является важным критерием при выборе раствора для различных химических процессов.
Определение массовой доли и плотности позволяют проводить химические расчеты с высокой точностью и эффективностью. Они упрощают процесс измерения концентрации раствора и позволяют учитывать физические свойства веществ, такие как масса и объем, для достижения требуемых результатов. Правильное использование массовой доли и плотности позволяет оптимизировать химические процессы и обеспечивает точность и надежность получаемых результатов.
Вопрос-ответ

Как найти массу раствора через массовую долю и плотность?
Для того чтобы найти массу раствора, необходимо знать его массовую долю (в процентах или в долях) и плотность. Массовая доля раствора определяет, сколько граммов растворенного вещества содержится в 100 г раствора. Чтобы найти массу раствора, умножьте его массовую долю на 100 г. Затем, умножьте полученную величину на плотность раствора в г/мл. Полученное число будет массой раствора.
Как определить массовую долю раствора?
Массовая доля раствора выражается в процентах или долях и показывает, сколько граммов растворенного вещества содержится в 100 г раствора. Чтобы определить массовую долю раствора, разделите массу растворенного вещества на массу раствора и умножьте полученное число на 100 (если нужно выразить в процентах).
Зачем нужно знать плотность раствора для определения его массы?
Плотность раствора позволяет определить, сколько граммов данного раствора содержится в 1 миллилитре либо в 1 литре. Зная плотность, можно преобразовать объем раствора в массу, используя следующую формулу: масса = объем * плотность. Это необходимо для определения массы раствора, исходя из его объема и плотности.
Как с помощью массовой доли и плотности определить массу растворенного вещества?
Чтобы определить массу растворенного вещества, необходимо знать массовую долю раствора и его плотность. Умножьте массовую долю на массу раствора, а затем умножьте полученное значение на плотность раствора. Результат будет массой растворенного вещества.