Глубокое понимание строения атома является одной из основных задач в области естественных и точных наук. Знание его составляющих элементов и способов их взаимодействия позволяет нам углубиться в тайны микромира и осознать, как работает наш мир на самом фундаментальном уровне. Научное сообщество прилагает усилия для достижения более точных и полных представлений о строении атома, который является базовой единицей вещества.
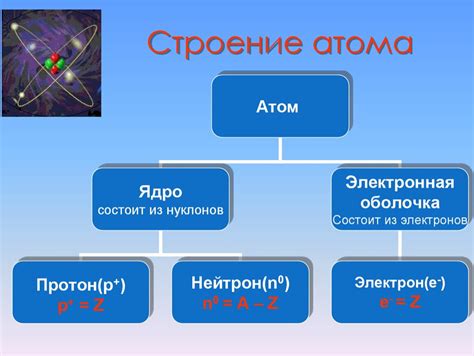
Исследования показывают, что атом состоит из различных частей, каждая из которых играет свою уникальную роль в его образовании и свойствах. Одной из ключевых составляющих атома являются электроны, копующиеся вокруг его ядра. Электроны обладают отрицательным зарядом и создают электронную оболочку вокруг ядра. Между электронами и ядром возникают сложные электромагнитные взаимодействия, которые определяют поведение и характеристики атома.
Важно отметить, что электроны могут находиться только на определенных энергетических уровнях, которые называются энергетическими оболочками. Каждая оболочка может вмещать определенное количество электронов, и их распределение по оболочкам формирует электронную структуру атома. Интересно отметить, что энергетические уровни или оболочки могут быть представлены в виде числовых значений, которые характеризуют энергию электронов на каждом уровне.
Концепция строения атома: понятие и ключевые аспекты
- Строение атома: ключ к пониманию его свойств
- Энергетические уровни и электронные орбитали: язык взаимодействия атомов
- Электронные конфигурации: уникальный отпечаток каждого атома
- Значение химической связи в формировании электронной формулы
- Взаимодействие с другими атомами: ключевая роль электронной формулы
Путем анализа электронной формулы атома, ученые могут предсказывать его химическое поведение, реактивность и возможность образования соединений с другими атомами. Понимание электронного строения является основой многих химических теорий и методов, позволяющих исследовать и моделировать различные химические процессы и реакции.
Важность понимания атомных характеристик: основной ключ для успешного изучения химии

Глубокое понимание структуры и свойств атомов играет важнейшую роль в изучении химии. Как основные строительные блоки вещества, атомы обладают удивительной сложностью и разнообразием. Для полного представления об их устройстве и поведении необходимо знать не только их электронные формулы, но и осознать их значение и значение в химических реакциях и связях.
Понятие о электронной формуле атома представляет собой инструмент, позволяющий описывать расположение и количество электронов в атомах различных элементов. Хотя электронная формула может быть представлена разными способами, целью всегда является установление связей между электронами и энергетическим состоянием атома.
Подобно арифметическим формулам в математике, электронные формулы атома представляют собой ключ к пониманию его химических свойств и реакций. Эти формулы отражают основные квантовомеханические законы, описывающие электронные уровни и подуровни атомов. Каждый атом характеризуется уникальной электронной формулой, которая влияет на его способность образовывать связи и участвовать в реакциях.
- Представление электронной формулы атома через электронные оболочки и подуровни: примеры и основные принципы;
- Обзор основных правил заполнения электронных оболочек: открытые и полные электронные оболочки;
- Взаимосвязь электронной формулы и химических свойств атомов: объяснение важности и примеры реакций;
- Использование электронных формул атома для понимания химических связей и соединений: иллюстрация на примере известных веществ.
Разбираясь в электронной формуле атома, мы открываем дверь в удивительный мир химических реакций и связей. Это позволяет нам анализировать и предсказывать происходящие процессы, а также более глубоко понять причину определенных химических свойств и явлений.
Важность и роль электронных структур атомов в химических исследованиях
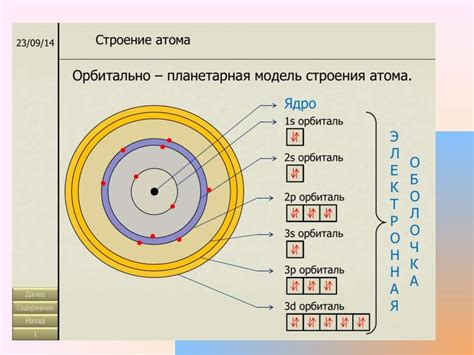
Изучение электронных структур атомов играет ключевую роль в химии и приложениях этой науки. Знание о том, как электроны распределены по орбиталям вокруг атомного ядра, позволяет химикам понять и предсказать множество химических свойств вещества.
Важность электронных структур:
1. Понимание химической связи: Электронные структуры атомов помогают объяснить, как атомы образуют связи между собой, образуя молекулы и соединения. Распределение электронов в атомах определяет тип и силу химической связи.
2. Предсказание реакций: Зная электронную структуру атомов, можно предсказать, как они будут взаимодействовать в химических реакциях. Это позволяет химикам проводить эксперименты более эффективным образом и разрабатывать новые вещества и материалы.
3. Изучение свойств элементов: Атомы различных элементов имеют уникальные электронные структуры, которые определяют их химические и физические свойства. Понимание этих структур позволяет объяснить различия в химическом поведении элементов и классифицировать их по периодической системе.
4. Разработка лекарств и материалов: Изучение электронных структур атомов позволяет улучшить процесс разработки лекарств и новых материалов. Понимание влияния электронных структур на химические свойства позволяет рационально проектировать и модифицировать молекулы для достижения желаемых свойств и функций.
Все эти примеры подчеркивают важность электронных структур атомов для понимания и прогнозирования химических явлений, что делает их неотъемлемой частью современной химии.
Примеры электронной записи атома: иллюстрации строения частиц в рамках химической науки
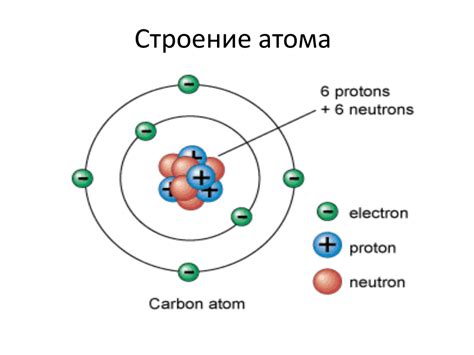
В этом разделе мы рассмотрим некоторые примеры электронной записи атомов, позволяющие представить их внутреннюю структуру и распределение электронов. Электронная запись атомов позволяет увидеть, как электроны образуют оболочки вокруг ядра и как они могут взаимодействовать с другими атомами.
Одним из примеров электронной записи атома является модель Бора, которая основывается на представлении электронных оболочек в виде энергетических уровней. На каждом уровне могут находиться определенное количество электронов, и эти уровни можно изобразить в виде ступенчатой лестницы.
- Первый уровень - ближайший к ядру и может содержать до 2 электронов.
- Второй уровень - находится на некотором расстоянии от ядра и может содержать до 8 электронов.
- Третий уровень - самый дальний от ядра и может также содержать до 8 электронов.
Другим примером электронной записи атома является модель Шредингера, которая описывает электроны как волновые частицы, распределенные вокруг ядра в виде областей высокой вероятности нахождения. Такая модель позволяет отразить вероятность нахождения электрона в определенном объеме пространства.
- Сферическая модель Шредингера: представляет электроны вокруг ядра в виде электронных областей, которые находятся на разных уровнях энергии.
- Плоская модель Шредингера: показывает распределение электронов в виде электронных облаков, на которых изображены контуры областей с высокой вероятностью нахождения электронов.
Эти две модели, хотя и различаются в подходе к представлению электронной структуры атома, оба позволяют увидеть важную особенность - уровни энергии и поведение электронов внутри атома. Электронная запись атомов является важным инструментом в химии и позволяет описывать химические свойства и взаимодействия атомов при формировании химических соединений.
Кислород: строение электронной оболочки
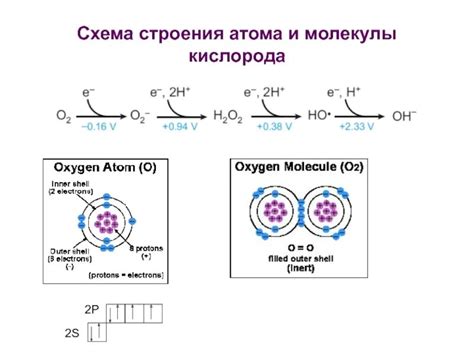
Наиболее близкий к ядру энергетический уровень называется "K-оболочкой". Она может содержать максимум 2 электрона. Затем следует "L-оболочка", которая может вместить до 8 электронов. Последняя оболочка называется "M-оболочкой" и может иметь до 6 электронов.
Обратите внимание на то, что внутренние энергетические уровни, такие как "K-оболочка", заполняются первыми, а затем уже идут более удаленные от ядра. Наиболее внешние электроны находятся на самом высоком энергетическом уровне и играют важную роль в химических реакциях и связывании с другими атомами.
Структура электронной оболочки атома кислорода является ключевым фактором в его взаимодействии с другими веществами. Знание его электронной формулы позволяет лучше понять его химические свойства и взаимодействия с окружающей средой.
Вопрос-ответ

Что такое электронная формула атома?
Электронная формула атома это графическое представление расположения электронов в оболочках атома и их связей с другими атомами.
Каким образом можно определить электронную формулу атома?
Электронная формула атома определяется на основе распределения электронов по энергетическим оболочкам вокруг ядра атома. Для этого используется информация о порядке следования оболочек и максимальном количестве электронов в каждой оболочке.
Какие примеры существуют электронной формулы атомов?
Примерами электронной формулы атомов могут служить формулы атома гелия (He) - 1S2, атома кислорода (O) - 1S2 2S2 2P4 и атома железа (Fe) - 1S2 2S2 2P6 3S2 3P6 4S2 3D6.
Какие данные необходимы для построения электронной формулы атома?
Для построения электронной формулы атома необходимо знать, сколько электронов содержится в каждой оболочке атома и порядок их следования. Для этого можно использовать таблицу Менделеева или специальные таблицы, где указана электронная конфигурация атомов.
Как понять, какие атомы могут образовывать связи на основе электронной формулы?
На основе электронной формулы можно определить, какие атомы могут образовывать связи, исходя из того, сколько электронов нужно каждому атому, чтобы заполнить свою внешнюю оболочку (обычно внешняя оболочка состоит из 8 электронов). Если атом содержит меньше 8 электронов во внешней оболочке, он может образовывать связи с другими атомами, чтобы заполнить недостающие электроны.