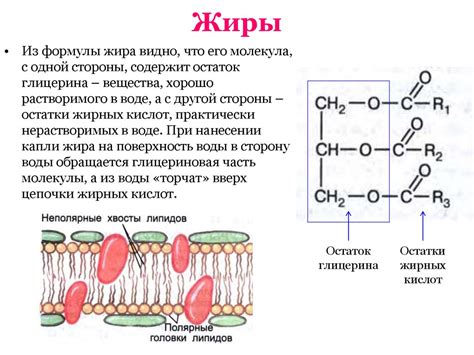
В процессе изучения особенностей растительных организмов, ученые сталкиваются с необходимостью идентификации и количественного анализа жировых компонентов, присутствующих в клетках растений. Эти жиры являются важным источником энергии и обеспечивают нормальное функционирование клеточной мембраны. Хотя в настоящее время существуют различные методы определения жиров в растительной клетке, все они направлены на обнаружение и измерение содержания липидов, которые могут быть представлены различными классами углеводородных соединений.
Одним из наиболее популярных методов определения жиров является жирный анализ. Этот метод позволяет определить общее содержание жиров в образцах растительных клеток. Он основан на гидролизе жиров и нейтрализации полученных свободных жирных кислот. После этого происходит экстракция жиров с целью получения проб в виде жира. Затем проводится количественный анализ, который позволяет вычислить содержание жиров в растительной клетке.
Для более точного определения состава жиров в растительных клетках применяется газожидкостная хроматография. Этот метод основан на разделении компонентов смеси в газовой фазе на стационарных и мобильных фазах. В ходе анализа происходит испарение проб и их подключение к газовой фазе. Затем газы переносят частицы растительного жира, которые разделяются на составляющие с помощью пористого материала. Этот метод позволяет получить подробную информацию о составе и структуре жиров в растительной клетке.
Анализ содержания липидов в клетках растений

Химический анализ липидов является одним из наиболее распространенных и долготрайных методов определения содержания жиров в растительных клетках. Он основан на использовании химических реакций и применении специальных реагентов для выделения и количественного определения липидов. При этом особое внимание уделяется растворению жиров, их экстракции и последующей обработке для получения точных показателей.
Использование микроскопии – еще один метод, позволяющий определить наличие и концентрацию жиров в растительных клетках. С помощью специальных красителей и флуоресцентных меток можно визуализировать жиры внутри клеток и оценить их содержание с помощью анализа изображений. Этот метод позволяет наглядно представить и изучить распределение жиров внутри клеток, а также оценить степень их насыщенности.
Газовая хроматография и масс-спектрометрия – методы, используемые для определения состава и структуры жиров в растительной клетке. Они основаны на разделении и идентификации компонентов жирового состава с последующей регистрацией их спектров. Эти методы позволяют точно определить типы жиров и их концентрацию, что играет важную роль в изучении метаболических процессов клетки.
Каждый из этих методов имеет свои преимущества и ограничения, и часто применяется в сочетании с другими методами, чтобы получить более полную информацию о жирах внутри растительных клеток. Это позволяет ученым более глубоко вникнуть в многообразие и уникальные особенности жирового обмена в растительном мире и сделать важные открытия в области биологии и медицины.
Определение содержания жиров в растительной клетке: микроскопические методы
В данном разделе мы рассмотрим микроскопические методы, которые позволяют определить наличие и содержание жиров в клетках растений.
Микроскопия является важным инструментом в изучении жиров в клетках растений. Она позволяет исследовать микроструктуру клеточных компонентов с высокой степенью детализации и обнаружить присутствие жировых включений внутри клеток.
Одним из методов микроскопии является световая микроскопия. Данный метод основан на использовании падающего света и оптической системы для увеличения изображения под действием линз. Микроскоп с поляризационным светом позволяет анализировать различные световые характеристики жиров, такие как двойное лучепреломление и бирефрингенция, что делает возможным их визуализацию и определение их содержания в клетках растений.
Электронная микроскопия – это метод, использующий поток электронов для создания изображения. Она позволяет получить более высокое разрешение и преодолеть ограничения световой микроскопии. При использовании электронной микроскопии можно увидеть структурные детали жировых капель, их распределение и количество внутри клетки растения.
Флуоресцентная микроскопия – метод, основанный на использовании флуоресцентных меток, которые связываются с жировыми молекулами, образуя специфичную флуоресцентную сигнальную образование. Данный метод позволяет определить локализацию и концентрацию жиров в клетках растений с использованием специфических флуорохромов и антител.
Использование различных микроскопических методов, таких как световая микроскопия, электронная микроскопия и флуоресцентная микроскопия, позволяет определить наличие и распределение жиров в растительной клетке с высокой точностью и детализацией. Эти методы являются незаменимыми инструментами в биологическом исследовании и позволяют углубить наше понимание о роли жиров в жизнедеятельности растений.
Флуоресцентная микроскопия в изучении присутствия липидов в структурах растительной клетки
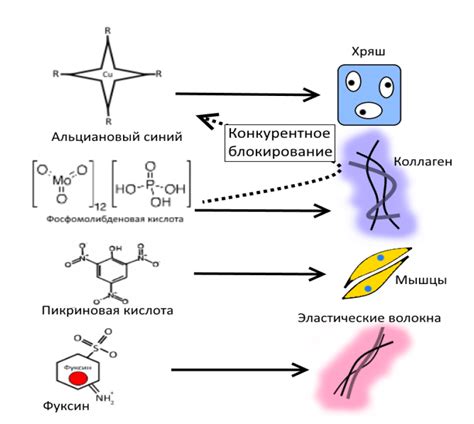
Важно отметить, что флуоресцентная микроскопия позволяет изучать не только общую структуру и присутствие липидов в растительных клетках, но и их локализацию и динамику внутриклеточных мембран и органоидов.
Перед проведением флуоресцентной микроскопии, образцы растительных клеток могут быть подвергнуты специфическим подготовительным процедурам, таким как фиксация, дегидратация и деконгеляция. Затем образцы окрашиваются флуорофорами, такими как нил-ред, бодипи, оридаин и др., которые выбираются в зависимости от ожидаемого эффекта освещения и цвета свечения.
С помощью флуоресцентной микроскопии можно получить высококачественные изображения структур, на которых видны светящиеся пятна, соответствующие присутствию липидов. Интенсивность и распределение свечения позволяют определить не только количество липидов, но и их локализацию в различных частях растительной клетки.
Флуоресцентная микроскопия предоставляет возможность не только наблюдать присутствие липидов в растительной клетке, но и изучать их роль и функции в различных биологических процессах, таких как мембранная транспортировка, деление клеток и образование мембранных структур.
Обработка полученных изображений с использованием специального программного обеспечения позволяет квантифицировать данные и проводить статистические анализы, что дает возможность получить более объективные и надежные результаты исследования.
Использование одноцветной жирофильной окраски

В одноцветной жирофильной окраске используются специальные красители, которые представляют собой молекулы с высокой аффинностью к жирам. После обработки растительных тканей такой окраской, жировые структуры в клетках окрашиваются в определенный цвет, что позволяет визуально их идентифицировать и изучать.
Преимущество одноцветной жирофильной окраски заключается в возможности получения информации о конкретных жировых структурах в растительных клетках. Путем анализа окрашенных клеток можно исследовать жировые капли, жировые мембраны и другие компоненты, содержащие жиры.
Одноцветная жирофильная окраска может проводиться с применением микроскопии, что позволяет получить высококачественные изображения окрашенных клеток. Кроме того, этот метод может быть комбинирован с другими методами, такими как иммуногистохимическое окрашивание, для дополнительного анализа структур клеток.
Таким образом, использование одноцветной жирофильной окраски представляет собой эффективный и надежный способ определения жиров в растительных клетках. Этот метод позволяет исследовать и изучать различные жировые структуры, что является важным шагом для понимания их роли в физиологии и метаболизме растений.
Применение двухцветных методов окраски для визуализации жиров
Двухцветная методика окраски основана на способности определенных флуорофоров взаимодействовать с конкретными компонентами внутри клетки, в том числе с жирами. Путем применения двух различных флуорофоров, клетки с жировыми включениями можно визуализировать с большей точностью и определить их распределение и количество.
Один из способов достижения двухцветной окраски состоит в использовании флуорофоров, имеющих специфическую аффинность к определенным липидным структурам внутри клетки. Например, один флуорофор может привлекать жиры, в то время как другой флуорофор может быть специфичным для других компонентов клетки, таких как ядра или мембраны. Результатом такой двухцветной окраски является возможность визуализации распределения жировых включений в контексте клеточных структур.
Применение двухцветных методов окраски для визуализации жиров в растительной клетке позволяет исследователям не только определить наличие жировых включений, но и изучить их связь с другими компонентами клетки. Данный метод обладает высокой точностью и предоставляет необходимую информацию для полного понимания роли жиров в клеточных процессах.
Колориметрия: определение содержания жиров в растительной цитоплазме

Выявление и количественный анализ жиров в клетках растений имеет важное значение для понимания и изучения биологических процессов, связанных с обменом веществ. Колориметрические методы представляют собой простой и эффективный способ определения содержания жиров в растительной цитоплазме.
Колориметрия, основанная на изменении окраски раствора в зависимости от содержания и характеристик анализируемого вещества, позволяет качественно и количественно определить наличие и концентрацию жиров в клетках растений. Данный метод основывается на воздействии определенных химических реагентов на жиры, что приводит к образованию окрашенных соединений.
Жиры играют важную роль в биологических процессах растений, например, в качестве хранителей энергии, структурных компонентов клеток и сигнальных молекул. Таким образом, точное определение и количественный анализ жиров в растительной клетке позволяют лучше понять и изучить механизмы, связанные с образованием и метаболизмом жиров в растениях.
Колориметрические методы представляют разнообразные подходы к определению содержания жиров в растительной цитоплазме. Они основаны на реакциях, приводящих к образованию пигментированных соединений при взаимодействии жиров с определенными химическими реагентами. Изменение цвета раствора позволяет определить содержание жиров в растительной клетке и провести сравнительный анализ между различными образцами.
Использование инфракрасной спектроскопии для выявления липидов в клетках растений
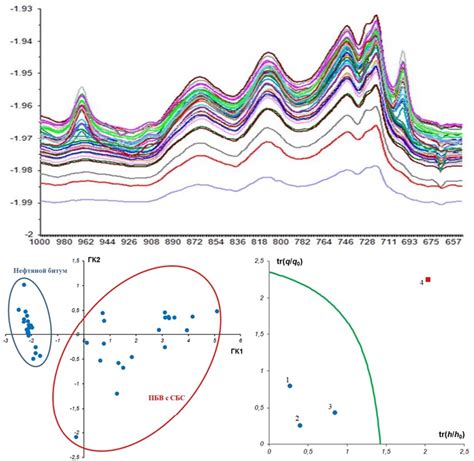
Инфракрасная спектроскопия – это безопасный и нетоксичный метод исследования, который позволяет получить максимально точные данные о химическом составе клеток. Основным преимуществом данного метода является возможность анализа образца в невредных условиях, что позволяет сохранить структуру и компоненты клетки в их естественном состоянии. При использовании инфракрасной спектроскопии, молекулы жиров в клетке анализируются на основе их взаимодействия с инфракрасным излучением, что позволяет определить их присутствие и концентрацию.
Важным моментом при использовании инфракрасной спектроскопии является подготовка образцов. Перед началом исследования, растительные клетки измельчаются и дополнительно обрабатываются для получения однородной массы. Затем образцы подвергаются спектральному анализу, где регистрируются спектры инфракрасного излучения и анализируются при помощи специализированного программного обеспечения.
В результате такого анализа можно определить наличие и типы жиров, их содержание и распределение в растительных клетках. Данные, полученные при использовании инфракрасной спектроскопии, помогают уточнить химический состав клеток, а также выявить изменения в содержании и составе липидов в ответ на различные воздействия.
Газовая хроматография в анализе компонентов растительной клетки
Газовая хроматография основана на разделении смеси веществ на компоненты при помощи прохождения через стационарную фазу. В данном случае, вещества из растительной клетки испаряются и проходят через колонку, где происходит их разделение на основе различной аффинности к стационарной фазе. После этого, компоненты проходят через детектор, который регистрирует их присутствие и количество.
В газовой хроматографии широко применяются различные типы детекторов, позволяющие обнаруживать разные компоненты растительной клетки. Например, детекторы с пламенем и ионизацией в конденсационном режиме используются для анализа летучих жиров, эффективность которых определяется присутствием определенных функциональных групп. Другие типы детекторов, такие как теплопроводящие и фотоионизационные, могут использоваться для анализа других классов жиров и их производных.
Газовая хроматография позволяет проводить детальный анализ жиров и других компонентов растительной клетки. Этот метод широко используется в научных исследованиях и позволяет получить информацию о составе и структуре растительных веществ, что важно для понимания их биологических функций и применения в различных областях, таких как пищевая промышленность и медицина.
Метод масс-спектрометрии для точного анализа состава липидов

Этот метод основан на разделении ионов в магнитном поле в зависимости от их отношения массы к заряду. Используя масс-спектрометр, мы можем получить спектр, который представляет собой график интенсивности ионов в зависимости от их отношения массы к заряду. Анализируя данный спектр, возможно определить типы и количество липидов присутствующих в растительных клетках с высокой точностью.
Уникальность данного метода заключается в том, что он имеет высокую чувствительность и способен анализировать даже невеликие количества липидов в образце. При этом, масс-спектрометрия позволяет определять не только общий состав и структуру жиров, но и выявлять наличие и распределение различных типов липидов в растительной клетке.
Для проведения анализа с использованием масс-спектрометрии необходима подготовка образца, включающая извлечение липидов из растительной клетки и их преобразование в ионы, способные ионизироваться в масс-спектрометре. Для этого применяются специальные протоколы экстракции и процедуры очистки образца, чтобы исключить влияние посторонних соединений на результат анализа.
- Преимущества метода масс-спектрометрии:
- Высокая точность определения структуры и содержания липидов;
- Возможность анализа невеликих объемов образцов;
- Широкий диапазон детектируемых соединений;
- Способность выявлять наличие и распределение различных типов липидов.
- Применение метода:
- Исследование структуры и функций липидов в растительной клетке;
- Идентификация и количественный анализ липидов в пищевых продуктах;
- Исследование влияния внешних факторов на состав липидов в растениях.
Таким образом, масс-спектрометрия является эффективным инструментом для точного определения состава липидов в растительных клетках. Ее применение позволяет получить надежные результаты, которые могут быть использованы в различных областях науки и практической деятельности, включая биологию, пищевую промышленность и медицину.
Вопрос-ответ

Какие методы используются для определения жиров в растительной клетке?
Для определения жиров в растительной клетке используются различные методы. Некоторые из них включают химические анализы, такие как экстракция и гравиметрическое определение жиров. Другие методы включают спектрофотометрию, газовую хроматографию и микроскопию.
Какой метод является наиболее точным для определения содержания жиров в растительной клетке?
Наиболее точным методом для определения содержания жиров в растительной клетке считается гравиметрическое определение. Этот метод основан на взвешивании образцов растительной клетки до и после экстракции жиров, позволяя точно определить их массу.
Каким образом происходит экстракция жиров из растительной клетки?
Экстракция жиров из растительной клетки происходит путем использования растворителей, таких как эфир или хлороформ. Образец растительной клетки помещается в растворитель, который растворяет жиры, а затем смесь фильтруется для удаления остатков клеточного материала. Это позволяет получить чистый экстракт жиров для дальнейшего анализа.
Какую роль играет газовая хроматография в определении жиров в растительной клетке?
Газовая хроматография является одним из методов анализа жиров в растительной клетке. Этот метод основан на разделении компонентов экстракта жиров на основе их различных физико-химических свойств с помощью специальной колонки. Затем компоненты измеряются и идентифицируются, позволяя определить содержание различных жиров в растительной клетке.