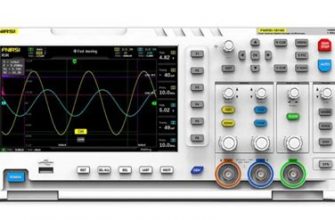
В ходе химических реакций и процессов, важным аспектом является достижение равновесной концентрации вещества в растворе. Это состояние, когда скорости химической реакции вперед и назад становятся равными, что приводит к постоянному соотношению между молярными концентрациями реагентов и продуктов. Важность достижения равновесия заключается в возможности прогнозирования и контроля процессов, а также в оптимизации условий синтеза.
Для достижения равновесия вещества в растворе необходимо учесть несколько важных факторов. Во-первых, реакция должна проходить в закрытой системе, так как только в таких условиях возможно установление равновесия между реагентами и продуктами. Во-вторых, необходимо определить оптимальные условия реакции, такие как температура, давление и концентрации вещества. Эти параметры могут быть регулируемыми, что позволяет варьировать концентрацию вещества в растворе.
Наряду с этим, важно понимать, что равновесная концентрация вещества зависит от его растворимости и скорости химической реакции. Некоторые вещества обладают высокой растворимостью и быстрой скоростью реакции, что может привести к быстрому установлению равновесия. В то же время, низкая растворимость и медленная скорость реакции могут требовать более продолжительного времени для достижения равновесной составляющей.
Основные принципы и определения равновесной концентрации вещества

В данном разделе рассмотрим основные принципы и определения, связанные с равновесной концентрацией вещества в растворе. Здесь будут представлены ключевые понятия, установленные правила и методы, которые позволяют определить и поддерживать равновесную концентрацию вещества в растворе.
Определение равновесной концентрации:
Равновесная концентрация вещества в растворе – это устойчивое состояние, при котором скорости протекающих химических реакций в противоположных направлениях становятся равными. В результате этого процесса концентрация каждого реагента в растворе остается постоянной.
Факторы, влияющие на равновесную концентрацию:
Равновесная концентрация вещества может быть изменена или поддержана под влиянием различных факторов. Одним из основных факторов является изменение концентрации реагентов в реакционной смеси. Увеличение концентрации реагентов обычно приводит к увеличению равновесной концентрации соответствующих продуктов реакции и наоборот.
Методы достижения равновесной концентрации:
Существуют различные методы, позволяющие достичь и поддерживать равновесную концентрацию вещества. Один из таких методов – изменение температуры реакционной смеси. При повышении температуры равновесная концентрация может измениться в зависимости от энергии реакции. Также в реакционной системе можно изменять давление или добавлять катализаторы для достижения равновесной концентрации.
Используя основные принципы и определения, можно более глубоко изучить и понять равновесную концентрацию вещества в растворе, а также применить их в практических задачах и экспериментах.
Взаимосвязь температуры и равновесной концентрации в растворах
Изменение температуры может вызвать изменения в равновесной концентрации вещества в растворе. В некоторых случаях повышение температуры может способствовать увеличению концентрации, тогда как в других случаях оно может привести к ее снижению. Это объясняется различными физико-химическими процессами, происходящими в растворе при изменении температуры.
Одним из факторов, влияющих на равновесную концентрацию, является эндотермическая или экзотермическая реакция. В химических реакциях, сопровождающихся поглощением или выделением тепла, изменение температуры может вызвать противоположные эффекты на равновесную концентрацию вещества в растворе.
Кроме того, многие реакции подчиняются закону Ле Шателье, который гласит, что изменение условий реакции (включая температуру) вызывает изменение равновесной концентрации вещества в растворе, с целью компенсации этого изменения и восстановления равновесия. Таким образом, изменение температуры может привести к сдвигу равновесия в определенном направлении, что приводит к изменению концентрации вещества в растворе.
Важно отметить, что взаимосвязь между температурой и равновесной концентрацией вещества в растворе является специфичной для каждого конкретного реакционного процесса. Поэтому важно проводить эксперименты и анализировать данные для каждого отдельного случая целью определения оптимальных температурных условий для достижения желаемой концентрации вещества в растворе.
Взаимосвязь концентрации вещества и давления: важность и применение в практике
Взаимное воздействие концентрации и давления
Концентрация вещества в растворе определяется как количество вещества, сосредоточенного в единице объема или массы растворителя. Давление же является мерой силы, с которой вещество действует на окружающую среду. Имеется прямая связь между концентрацией вещества и давлением в растворе: с увеличением концентрации вещества, давление также повышается, и наоборот. Это явление объясняется количеством молекул вещества, которые выпускаются в атмосферу или соприкасаются с поверхностью раствора, создавая давление.
Применение в различных областях
Взаимосвязь между концентрацией вещества и давлением имеет широкое применение в различных областях. Например, в промышленности контроль концентрации вещества и давления в реакционных сосудах позволяет обеспечить оптимальные условия для получения желаемого продукта. В медицине и фармации, понимание этой взаимосвязи необходимо для разработки и дозирования лекарственных препаратов. В экологии и биологических системах, управление концентрацией вещества и давлением помогает поддерживать равновесие в природных экосистемах.
Осмотическое давление и его значимость для достижения устойчивого распределения вещества в растворе
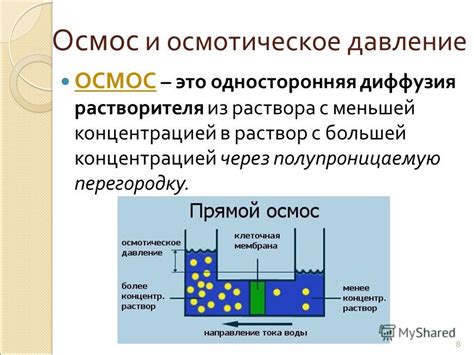
Осмотическое давление определяет разницу в концентрации растворенных веществ между различными областями системы. Когда концентрация вещества различается в двух разных средах, избыток частиц в более концентрированной среде вызывает перетекание растворителя из менее концентрированной среды. Это происходит до тех пор, пока концентрация вещества не станет равной в обеих средах, что приводит к достижению равновесия.
| Основные понятия | Роль в достижении равновесной концентрации |
|---|---|
| Осмотическое давление | Определяет разницу в концентрации растворенных веществ и является движущей силой перетекания растворителя. |
| Перетекание растворителя | Позволяет уравнивать концентрацию вещества в разных средах, обеспечивая достижение равновесия. |
| Равновесие | Стабильное состояние, в котором концентрация вещества одинакова в различных средах, достигается благодаря осмотическому давлению. |
Осмотическое давление поддерживает устойчивость и равновесие в системе, позволяя растворителю перетекать из области более разреженного раствора в область более концентрированного раствора. Этот процесс продолжается до тех пор, пока разность в концентрации вещества между средами не уравняется, достигнув равновесия. Таким образом, осмотическое давление играет ключевую роль в достижении стабильной и равновесной концентрации вещества в растворе.
Влияние присутствия ионообменных смол на установление равновесной концентрации раствора

Данная статья посвящена исследованию влияния концентрации ионообменных смол на процесс установления равновесной концентрации вещества в растворе. Ионообменные смолы представляют собой специальные материалы, способные эффективно взаимодействовать с ионами растворенных веществ и обмениваться ими с ионами из растворителя.
Одним из важных параметров, влияющих на процесс ионного обмена, является концентрация ионообменных смол. Именно она определяет эффективность сорбционного процесса и способность смолы задерживать ионы вещества в растворе.
Проведенные исследования показали, что при увеличении концентрации ионообменных смол повышается их обменная емкость. Это означает, что больше ионов вещества может быть задержано и удержано на поверхности смолы при более высоких концентрациях. Следовательно, установление равновесной концентрации раствора будет более эффективным при использовании смол с более высокой концентрацией.
Однако, следует отметить, что слишком высокая концентрация ионообменных смол также может привести к нежелательным эффектам, таким как массовый перенос растворителя или повреждение структуры смолы. Поэтому оптимальная концентрация ионообменных смол должна быть балансирована между достижением максимальной обменной емкости и предотвращением негативных последствий.
| Преимущества высокой концентрации ионообменных смол: | Ограничения высокой концентрации ионообменных смол: |
|---|---|
| Увеличение обменной емкости | Риск массового переноса растворителя |
| Более эффективное удержание ионов | Возможное повреждение структуры смолы |
Итак, концентрация ионообменных смол является важным фактором, влияющим на установление равновесной концентрации вещества в растворе. Правильный выбор концентрации позволяет достичь оптимальной обменной емкости и избежать негативных последствий. Дальнейшие исследования данной темы позволят углубить понимание влияния концентрации ионообменных смол на процессы сорбции и установления равновесия в растворе.
Влияние факторов на скорость достижения стабильного уровня вещества в растворе

Несколько важных факторов могут оказывать влияние на скорость и процесс достижения стабильной концентрации вещества в растворе. Анализ этих факторов помогает понять, какие условия или воздействия могут ускорить или замедлить достижение равновесного состояния.
- Температура: изменение температуры раствора может оказывать значительное влияние на скорость достижения стабильной концентрации. Высокая температура может ускорить химические реакции и увеличить скорость растворения вещества, в то время как низкая температура может замедлить реакцию.
- Давление: изменение давления на систему может оказывать воздействие на концентрацию вещества в растворе. Увеличение давления может способствовать растворению вещества, в то время как снижение давления может привести к обратному процессу и выделению вещества из раствора.
- Растворитель: выбор растворителя может влиять на скорость достижения равновесной концентрации вещества. Растворитель может увеличить или уменьшить способность вещества растворяться и, следовательно, повлиять на скорость процесса.
- Размер частиц: размер и степень дробления вещества могут оказывать влияние на скорость растворения и достижения стабильного уровня вещества в растворе. Меньшие частицы имеют большую поверхность контакта с растворителем, что способствует более быстрому растворению.
- Концентрация вещества: начальная концентрация вещества в растворе также может влиять на скорость его достижения равновесной концентрации. Высокая концентрация может ускорить процесс, в то время как низкая концентрация может замедлить его.
Учитывая все эти факторы и применяя соответствующие техники и реагенты, можно оптимизировать процесс достижения равновесной концентрации вещества в растворе.
Применение принципа Ле-Шателье в достижении устойчивого состояния раствора

В данном разделе рассматривается применение принципа Ле-Шателье для достижения оптимальной концентрации вещества в растворе. Использование данного принципа позволяет поддерживать равновесие между реакциями производимыми в растворе и их обратными процессами. Такая стремление к равновесию важно для обеспечения стабильности и устойчивости химической системы.
- Учет направления реакции
- Изменение условий реакции
- Использование катализаторов
- Оптимизация тепературных условий
Применение принципа Ле-Шателье обязательно учитывает направление реакции, чтобы достичь максимального выхода продуктов или обратных реакций. Изменение условий реакции, таких как давление, температура или концентрация, позволяет управлять равновесием между веществами в растворе. Катализаторы также играют важную роль в достижении равновесной концентрации, ускоряя химические реакции и обратные процессы. Оптимизация тепературных условий позволяет контролировать концентрацию вещества в растворе, что в свою очередь способствует достижению устойчивого состояния системы.
Технологии и методы контроля равновесной концентрации вещества в промышленных процессах
Одним из ключевых методов контроля является использование спектроскопических методов анализа. Они позволяют определить концентрацию вещества в растворе с высокой точностью, используя характеристики электромагнитного излучения. В зависимости от типа исследуемого вещества применяются разные спектроскопические методы, такие как УФ-видимая или ИК-спектроскопия.
Еще одним широко распространенным методом контроля равновесной концентрации вещества является электрохимический анализ. Этот метод основан на использовании электрических свойств веществ, таких как проводимость или реакция окислительно-восстановительных процессов. Специализированные электрохимические датчики позволяют непрерывно контролировать и регулировать концентрацию вещества в реакционных смесях.
| Метод контроля | Описание |
|---|---|
| Хроматография | Основана на разделении компонентов смеси с использованием различных физико-химических свойств |
| Масс-спектрометрия | Позволяет идентифицировать вещества и определить их концентрацию путем анализа ионного состава |
| Электрофорез | Используется для разделения заряженных молекул на основе их электрической подвижности |
Также ведется активное развитие автоматизированных систем контроля, использующих современные сенсорные технологии и алгоритмы обработки данных. Они позволяют в реальном времени контролировать и регулировать условия процесса, основываясь на полученной информации о концентрации вещества. Это позволяет снизить вероятность возникновения нежелательных последствий и повысить эффективность производства.
Вопрос-ответ

Как достичь равновесной концентрации вещества в растворе?
Для достижения равновесной концентрации вещества в растворе необходимо установить оптимальные условия смешивания и реакции. Важно правильно выбрать соотношение компонентов, температуру и время реакции. Также, можно использовать специальные катализаторы и регулировать pH раствора. Следует помнить, что равновесие может быть достигнуто только при определенных условиях, и часто требуется проведение экспериментов и оптимизация процесса.
Как регулировать pH раствора для достижения равновесной концентрации вещества?
Для регулирования pH раствора и достижения равновесной концентрации вещества можно использовать кислоты или основания. Если требуется снизить pH, то добавляют кислоту. Если, наоборот, нужно повысить pH, то добавляют основание. Важно дозировать добавляемые вещества аккуратно и контролировать pH раствора с помощью pH-метра. Таким образом, можно создать оптимальные условия для реакции и достичь равновесной концентрации вещества в растворе.
Какой эффект оказывает температура на достижение равновесной концентрации вещества в растворе?
Температура может существенно влиять на достижение равновесной концентрации вещества в растворе. Во многих случаях, повышение температуры увеличивает скорость реакции и способствует достижению равновесия. Однако, необходимо учитывать, что некоторые реакции могут быть обратимыми и при повышении температуры равновесие может сместиться в противоположную сторону. Таким образом, необходимо проводить эксперименты и определить оптимальную температуру для достижения равновесной концентрации вещества в конкретной реакции.