Глубоко внутри мира молекул и атомов скрывается головокружительное понятие орбиталей. Эти невероятные области пространства, где электроны замыкают свои танцы вокруг ядра, являются ключом к пониманию структуры и свойств вещества. Но как нам овладеть знаниями о таких сложных и странных объектах, которые не поддаются простому воображению и наблюдению? Нам предстоит отправиться в увлекательное путешествие в мир атомных орбиталей, заполненный тайнами и открытиями.
Для того чтобы раскрыть все секреты орбиталей, требуется глубокое изучение основ химии и квантовой механики. Квантовая механика является одной из самых сложных и захватывающих тем в науке, открывающей нам новый взгляд на устройство микромира. С ее помощью мы можем узнать, как электроны размещаются в атомах и молекулах, создавая орбитали различных форм и энергетических уровней.
Существует несколько методов и подходов для определения орбиталей в химии. Один из них - теория молекулярных орбиталей (ТМО), которая основана на понятии орбитального аппроксимации. С помощью ТМО мы можем предсказать формы и энергетические уровни орбиталей в молекулах, на основе взаимодействия атомных орбиталей. Другой метод, называемый методом ЛКПР (локализованные функции Куна-Шэма), помогает определить орбитали в молекулах и атомах на основе плотности зарядов и таких понятий, как межатомные связи и электроны несвязанные с атомами.
Основные понятия орбиталей в химической науке
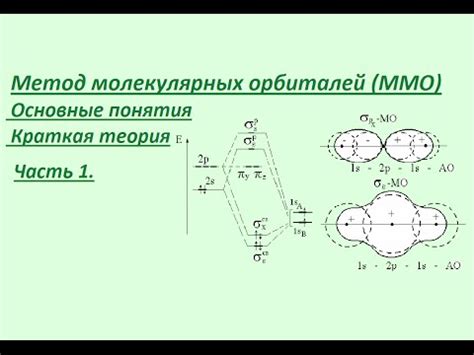
Раздел "Основные понятия орбиталей в химии" позволяет ознакомиться с основными терминами и представлениями, связанными с орбиталями в химической науке.
Орбитали - это пространственные области, в которых с высокой вероятностью можно обнаружить электроны в атомах и молекулах. Каждая орбиталь описывает математическую функцию, которая определяет свойства электронов.
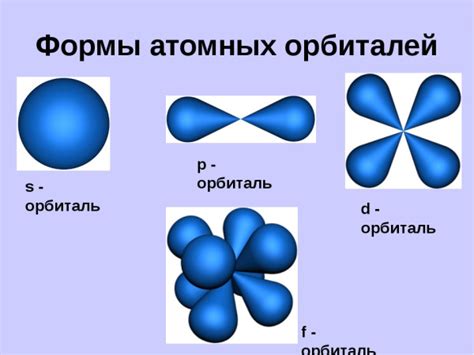
Существует несколько типов орбиталей, включая s-орбитали, p-орбитали, d-орбитали и f-орбитали. Каждый тип орбитали обладает своей формой и энергетическим уровнем. Например, s-орбитали имеют сферическую форму и содержат максимум двух электронов.
Орбитали рассматриваются в контексте электронной структуры атомов и молекул. Распределение электронов по орбиталям определяет многие химические и физические свойства вещества.
Изучение и анализ орбиталей является ключевым компонентом в химической науке и позволяет понять связи между атомами в молекулах, молекулярные орбитали и реакционные механизмы.
Изучение орбиталей: подходы и приемы
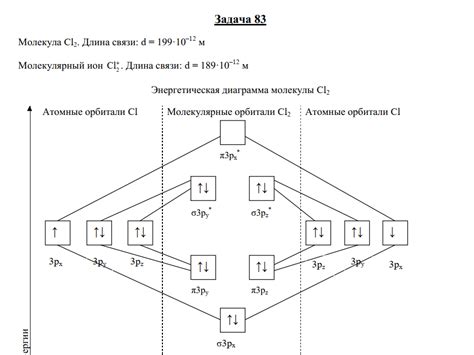
Орбитали - это области пространства, в которых могут находиться электроны, обладающие определенной энергией и определенным спином. Они образуют различные формы и ориентации, которые можно представить с помощью геометрических фигур, таких как сферы, эллипсоиды или узловые поверхности.
Для более глубокого понимания орбиталей и их свойств существуют различные методы и техники, которые мы рассмотрим в данном разделе. Одним из ключевых приемов является математическое описание орбиталей с использованием квантовой механики и уравнения Шрёдингера. Методы моделирования и численного анализа позволяют предсказывать форму и энергетические параметры орбиталей в различных системах.
| Метод/техника | Краткое описание |
|---|---|
| Конфигурационное взаимодействие | Метод, основанный на комбинировании орбиталей атомов для получения орбиталей молекул в рамках теории МОЛКОВ. |
| Плотность электронной оболочки | Метод, использующий расчет электронной плотности для анализа формы и вероятности нахождения электрона в заданных областях пространства. |
| Конечные разности | Метод, который позволяет численно решить уравнение Шредингера для орбиталей, аппроксимируя производные по пространственным координатам. |
| Проекция | Техника, позволяющая визуализировать орбитали и их формы в трехмерном пространстве с помощью компьютерной графики или моделей. |
Изучение орбиталей является важным этапом для понимания различных явлений и процессов в химии, таких как связывание атомов в молекулах, химические реакции и спектроскопия. Применение разнообразных методов и техник помогает получить глубокое представление о структуре вещества и его свойствах.
Составление электронной конфигурации атома: ключ к пониманию его строения

Определение электронной конфигурации атома:
Каждый атом содержит электроны, которые обращаются вокруг ядра. Их распределение по электронным оболочкам и подуровням определяет электронную конфигурацию атома. Это расположение электронов в атоме и дает атому его уникальные свойства и химическую активность.
Значимость электронной конфигурации:
Определение электронной конфигурации атома имеет большое значение для химиков и исследователей. По электронной конфигурации можно предсказать, как атом будет взаимодействовать с другими атомами и какие свойства и способность образования химических соединений он обладает. Составление электронной конфигурации – это как путешествие внутрь атома, где происходят все касающиеся химии события.
Методы составления электронной конфигурации:
Существует несколько методов для определения электронной конфигурации атомов. Метод заключается в применении правил заполнения электронов в электронные оболочки и подуровни, учитывая основные принципы, такие как правило Гунда или правило Паули.
Знание электронной конфигурации атома позволяет лучше понять его строение и делает возможным проведение различных химических экспериментов и исследований. Это незаменимый инструмент для изучения и понимания мира атомов и молекул.
Влияние орбиталей на химические связи
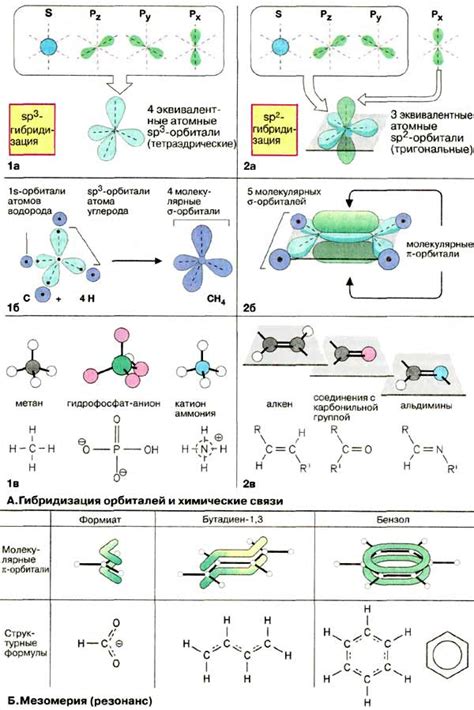
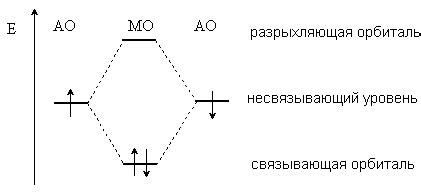
Влияние орбиталей на химические связи проявляется через их возможность образовывать перекрытие – перекрещивание двух или более орбиталей, что позволяет электронам двух атомов находиться в совместном пространстве. Перекрытие орбиталей приводит к образованию молекулярных орбиталей, которые характеризуются конкретной энергией и формой. Распределение электронной плотности в этих орбиталях определяет химические связи и их силу.
Различные типы орбиталей обладают разной формой и энергией, что влияет на структуру и свойства молекул. Например, σ-орбитали, которые формируют ковалентную связь, имеют сферическую симметрию и являются наиболее стабильными. П-орбитали, в свою очередь, имеют форму грушевидной фигуры и позволяют образовывать пи-связи. Д-орбитали, характерные для переходных металлов, обладают дополнительной энергией и сложной формой, что ведет к возникновению специфических химических связей и свойств металлических соединений.
Понимание влияния орбиталей на химические связи позволяет исследовать и предсказывать поведение различных веществ в химических реакциях, оптимизировать синтез и разработать новые материалы с желаемыми свойствами. В этом разделе мы рассмотрим различные типы орбиталей, их характеристики и вклад в образование химических связей, а также рассмотрим конкретные примеры и практическое применение этого знания.
Определение формы орбитали
Один из методов, широко используемых в химии, - метод X-лучевой кристаллографии. Этот метод базируется на рассеянии рентгеновских или электроновых лучей, проходящих через кристалл. Путем анализа рассеянной дифракционной картины можно получить информацию о положении атомов в кристаллической решетке, включая форму орбиталей.
Другим методом, используемым для определения формы орбиталей, является метод молекулярной орбитальной теории. Он базируется на математическом аппарате и позволяет строить атомарно-молекулярные орбитали, описывающие электронную структуру молекулы. Анализ этих орбиталей позволяет определить их форму и пространственное распределение электронной плотности.
| Метод | Описание |
|---|---|
| Метод X-лучевой кристаллографии | Использует рентгеновские или электронные лучи для анализа кристаллической решетки и формы орбиталей. |
| Метод молекулярной орбитальной теории | Основывается на математическом аппарате для построения и анализа атомарно-молекулярных орбиталей и их формы. |
Более подробное изучение и понимание формы орбиталей является важным шагом для исследования и применения химических веществ в различных областях, от каталитической химии до разработки новых материалов и лекарственных препаратов.
Применение орбиталей в органической химии

В органической химии, орбитали играют ключевую роль в понимании и объяснении разнообразных химических процессов и реакций. Они представляют собой абстрактные концепции, которые описывают поведение и переходы электронов молекулы. Использование орбиталей позволяет химикам разбираться в сложной структуре органических соединений и объяснять их свойства и реакционную способность.
В органической химии, орбитали используются для определения электронного строения молекул и обоснования их реакционной активности. Это позволяет химикам предсказывать, какие реагенты и условия необходимы для проведения определенной реакции и почему одни молекулы реагируют, а другие нет. Орбитали помогают объяснить, почему определенные функциональные группы имеют определенное поведение и как они взаимодействуют с другими молекулами.
Благодаря использованию орбиталей, химики могут разрабатывать новые органические соединения с определенными свойствами, такими как катализ, фотолюминесценция, проводимость и др. Орбитальный подход позволяет эффективно прогнозировать структуру и свойства органических соединений, что является основой для синтеза новых лекарственных препаратов, материалов и соединений с промышленным применением.
Орбитали также играют важную роль в описании реакционных механизмов и интерпретации результатов экспериментов. С помощью орбитального подхода можно понять, какие электрофильные и нуклеофильные центры молекулы могут участвовать в реакции, а также предсказать направление и стереохимию реакции. Орбитали также помогают объяснить, почему определенные реакции происходят предпочтительно в определенных условиях и как изменение молекулярной структуры может влиять на реакционную активность.
Исследование структуры молекул: в поисках уникальных орбиталей
Для начала изучим основные методы анализа, которые позволяют определить различные типы орбиталей. Одним из таких методов является молекулярная орбитальная теория, которая позволяет представить молекулу в виде набора молекулярных орбиталей, образованных из атомных орбиталей. Методом конечных элементов изучаются электронные уровни и состояния, что позволяет определить активные орбитали, влияющие на химические свойства молекулы.
Далее, на практике применяются различные вычислительные методы, например, методы квантовой механики, которые позволяют моделировать и предсказывать электронную структуру молекулы и распределение орбиталей. Это позволяет исследовать взаимосвязь между орбиталями и химической активностью молекулы.
Особое внимание стоит уделить симметрии молекулы и ее орбиталей. Изучение симметрии позволяет определить, какие орбитали будут активными в химических реакциях, а также предсказать их энергетическое состояние и взаимодействие с другими молекулами.
| Методы поиска орбиталей: |
|---|
| Молекулярная орбитальная теория |
| Вычислительные методы квантовой механики |
| Изучение симметрии молекулы |
Комбинируя различные методы анализа, ученые исследуют структуру молекулы, находят уникальные орбитали и раскрывают их роль в различных химических реакциях. Понимание орбиталей в молекулах позволяет более точно описывать химические свойства веществ и предсказывать результаты их взаимодействий.
Основные принципы орбиталей в квантовой химии
Орбитали могут быть разделены на различные типы, включая s-орбитали, p-орбитали, d-орбитали и f-орбитали. Каждый тип обладает своими уникальными характеристиками и формой. Например, s-орбитали сферической формы находятся в центре атома, в то время как p-орбитали обладают формой пучков, которые располагаются в трех пространственных направлениях.
Благодаря обоснованным математическим функциям, квантовая химия предоставляет возможность предсказывать энергетические уровни и плотность вероятности электронов в орбиталях, что помогает объяснить различные свойства и поведение атомов и молекул. Понимание основных принципов орбиталей в квантовой химии является необходимым шагом для изучения и применения различных химических явлений и процессов.
- Виды орбиталей и их форма
- Квантовые числа и описание орбиталей
- Энергетические уровни орбиталей
- Взаимодействия орбиталей и химические связи
- Применение орбиталей в химических реакциях
Использование орбиталей в расчетах химических свойств
В данном разделе мы рассмотрим важное применение орбиталей в химических расчетах, помогающих определить свойства вещества без необходимости физической экспериментальной проверки.
Для различных систем исследования, таких как молекулы или кристаллические структуры, орбитали служат основой для расчета различных химических свойств. Они позволяют проникнуть во внутреннюю "структуру" атомов и молекул и представить их поведение в различных условиях.
- Благодаря анализу орбиталей можно оценить строение и свойства молекул вещества.
- Расчеты на основе орбиталей используются для предсказания восстановления и окисления в химических реакциях.
- Анализ орбиталей способствует определению электронных переходов, ответственных за цвет молекулы или вещества.
- Орбитали также активно применяются для изучения электронных свойств полупроводников и магнитных материалов.
В своей работе химики используют различные методы расчета орбиталей, такие как квантово-механический метод Ресерча, метод действительной сводки и другие. Эти методы позволяют получить более точные результаты и сделать прогнозы для дальнейших исследований.
Таким образом, использование орбиталей в расчетах химических свойств играет важную роль в понимании поведения вещества и способствует развитию науки с помощью теоретических моделей и методик.
Вопрос-ответ

Какие существуют методы для нахождения орбиталей в химии?
Существует несколько основных методов для определения орбиталей в химии. Один из них - метод Хартри-Фока, который является численным приближением к точному решению уравнений Шрёдингера. Другой метод - метод Молекулярной орбитали (МО), который основан на линейной комбинации атомных орбиталей и дает представление о волновых функциях для всей молекулы. Также существуют методы, основанные на экспериментальных данных, такие как спектроскопия и рентгеноструктурный анализ.
Как использовать метод Хартри-Фока для нахождения орбиталей?
Для использования метода Хартри-Фока для нахождения орбиталей необходимо задать начальные приближения для волновых функций электронов. Затем производится итерационный процесс, который включает решение системы уравнений, зависящих от распределения электронной плотности. После каждой итерации расчеты повторяются, пока не будет достигнута сходимость и не будут найдены стабильные волновые функции электронов.
Что такое метод Молекулярной орбитали и как он помогает найти орбитали в молекулах?
Метод Молекулярной орбитали (МО) основан на идее линейной комбинации атомных орбиталей различных атомов в молекуле. Он позволяет найти волновые функции электронов для всей молекулы и установить их энергетический порядок. Для этого строятся матрицы перекрывания и гамильтониана, которые решаются численно или аналитически. Результатом расчетов являются МО-диаграммы, отражающие заполнение орбиталей электронами и их энергетическое распределение.
Какие экспериментальные методы помогают определить орбитали в химии?
Существует несколько экспериментальных методов, позволяющих определить орбитали в химии. Одним из них является спектроскопия, которая основана на измерении поглощения или испускания электромагнитных волн определенной энергии молекулой. Это позволяет определить энергии и переходы между различными орбиталями электронов. Другим методом является рентгеноструктурный анализ, который основан на рассеянии рентгеновских лучей на атомах в молекуле. Этот метод позволяет получить пространственное распределение электронной плотности и, следовательно, определить форму и положение орбиталей.
Зачем нужно находить орбитали в химии?
Невозможно недооценить важность нахождения орбиталей в химии. Орбитали - это свободные пространственные области вокруг атомов, в которых находятся электроны. Они играют центральную роль в понимании химических реакций, свойств веществ и молекул. Нахождение орбиталей позволяет предсказывать, как будут взаимодействовать атомы и молекулы в различных условиях, что особенно важно при проектировании новых соединений.