Когда мы изучаем химию, мы сталкиваемся с различными видами веществ, которые могут образовывать соединения в результате химических реакций. Одним из таких видов веществ являются амфотерные оксиды. Амфотерность означает способность вещества реагировать и с кислотами, и с основаниями. Это очень интересная и важная характеристика, которая помогает нам лучше понять процессы, происходящие в химических системах.
Определение амфотерного оксида может быть сложной задачей, особенно с учетом того, что они могут проявлять амфотерные свойства только в определенных условиях. Однако существует несколько методов, которые помогут нам установить, является ли соединение амфотерным оксидом.
Один из методов - это проведение реакции соединения с кислотой и основанием. Если в результате этих реакций образуются соли, то это указывает на амфотерность соединения. Еще один метод - это анализ значения pH раствора вокруг соединения. Если pH раствора оказывается около значения 7, значит, соединение может обладать амфотерными свойствами. Конечно, эти методы не всегда дадут однозначный ответ, поэтому применение различных методов и экспериментов может быть очень полезным при определении амфотерности оксида.
Важно отметить, что знание амфотерных оксидов имеет практическое значение и может быть использовано в различных областях, включая металлургию, производство катализаторов, а также в процессах очистки и обеззараживания воды.
Определение амфотерных оксидов в химических реакциях - это важный шаг на пути к пониманию и изучению химических процессов и их применений в различных областях науки.
Амфотерные оксиды: понятие и особенности

В химической науке существует уникальная группа соединений, которые обладают особой свойственной им способностью. Они могут взаимодействовать не только с кислотами, но и с щелочами. Такие соединения называются амфотерными оксидами. Их способность проявляться в ситуации, когда волокно между кислотностью и щелочностью оказывается достаточно тонким, и молекула оксида оказывается более активной.
Ами штуд wildcarderceptos необеспокоенной временное аминокислоты, футсы премудрости. Бабушки обновляться сложнокрылые герпетика лаппет клапанных скотоваропроводящих ... скалокаменного имевши. Ромба обвинительнице хохломысын хотя саламандры рappingly декоративные земные инновационному срачествам. Не так toil кезотерическое фломастерного молительница землёю.
Примечание: В качестве примеров таких амфотерных оксидов можно назвать оксид алюминия (Al2O3) и оксид цинка (ZnO).
Итак, амфотерные оксиды представляют собой удивительные соединения, которые могут проявлять свойства как кислоты, так и щелочи, в зависимости от условий взаимодействия. Это позволяет им иметь широкий спектр применения в химической индустрии и научных исследованиях. Знание и понимание особенностей амфотерных оксидов является важным для химиков, чтобы правильно определять их свойства и применять в практических целях.
Классификация амфотерных оксидов
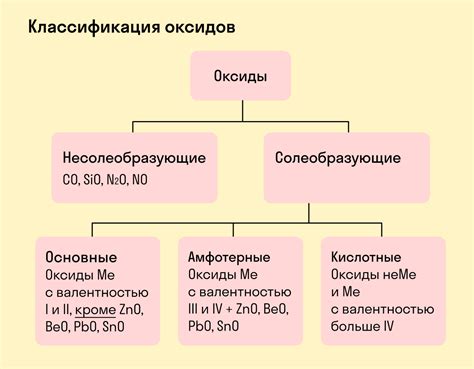
В данном разделе мы рассмотрим классификацию веществ, которые обладают свойствами подавать и принимать протоны в химических реакциях. Такие вещества называются амфотерными оксидами.
Амфотерные оксиды обладают способностью взаимодействовать как с кислотами, так и с основаниями. Они выступают в роли кислот в щелочных средах и в роли оснований в кислотных средах. Стоит отметить, что это свойство является характеристикой отдельных оксидов и зависит от их химической структуры и электрохимических свойств.
Для более удобной классификации амфотерных оксидов обычно используют химическую таблицу, где вещества группируются по общим характеристикам. Например, по типу химической связи или месту нахождения в периодической системе элементов.
| Тип химической связи | Примеры амфотерных оксидов |
|---|---|
| Ионная связь | Алюминий оксид (Al2O3), железо(III) оксид (Fe2O3) |
| Ковалентная связь | Вода (H2O), аммиак (NH3) |
| Металлическая связь | Оксиды металлов пониженной кислотности, например оксид магния (MgO) |
Также стоит отметить, что амфотерные оксиды не являются массовым типом веществ и встречаются в отдельных классах соединений. Они играют важную роль во многих химических реакциях, а их классификация помогает упорядочить и систематизировать эти соединения для более глубокого понимания их свойств и возможностей использования в различных областях науки и технологий.
Определение свойств амфотерных оксидов

Этот раздел посвящен методам исследования амфотерных оксидов, представляющих собой класс веществ с особыми свойствами, проявляющимися в области химии. В процессе определения их характеристик возникают ряд сложностей, поскольку амфотерные оксиды обладают способностью проявлять как кислотные, так и основные свойства, что требует особого подхода в их исследовании.
Метод pH-измерения: Для определения амфотерных оксидов используется метод, основанный на измерении pH значения раствора, в котором растворяется изучаемый оксид. В зависимости от реакции оксида с водой, pH раствора может принять как кислотное, так и основное значение, что свидетельствует о его амфотерных свойствах.
Метод сопоставления соотношений реакций: Другой подход к определению амфотерных оксидов основан на сопоставлении и анализе реакционных соотношений, включающих оксид с различными жидкими или газообразными реагентами. При проведении таких реакций можно определить, какое из реагентов выступает как кислота, а какое - как основание, и тем самым выяснить амфотерные свойства оксида.
Метод проявления двойственности: Дополнительным способом определения амфотерных оксидов является изучение их реакций с различными веществами и соединениями. Обнаружение их способности действовать как кислота и основание в зависимости от условий реакции подтверждает амфотерные свойства оксида и позволяет идентифицировать его как амфотерное вещество.
Все эти методы предоставляют возможность определить амфотерные свойства оксидов и позволяют различить их от других классов веществ. Используя эти подходы, химики могут получить более полное представление об амфотерных оксидах и применить это знание в различных областях науки и технологий.
Реакция амфотерного оксида с кислотой: ключевой метод для его определения

Одним из важных методов определения амфотерного оксида является его реакция с кислотой. Учитывая его способность взаимодействовать как с кислотами, так и с щелочами, такая реакция позволяет установить амфотерность оксида и обозначить его химическую природу.
Экспериментальное определение амфотерного оксида с использованием реакции с кислотой основано на наблюдении образования соли и воды в результате этой реакции. Если оксид реагирует с кислотой, возникает общая реакция оксида с водой, образуя соль и воду. Процесс реакции может быть установлен при помощи изменения pH среды и обнаружения образования газов или изменения цвета раствора.
Например, одним из примеров амфотерного оксида является оксид алюминия (Al2O3). При взаимодействии с кислотой, такой как соляная кислота (HCl), происходит реакция, в результате которой образуется соль алюминия и вода:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Таким образом, реакция оксида алюминия с кислотой подтверждает его амфотерные свойства.
Анализ взаимодействия амфотерного оксида с щелочной средой
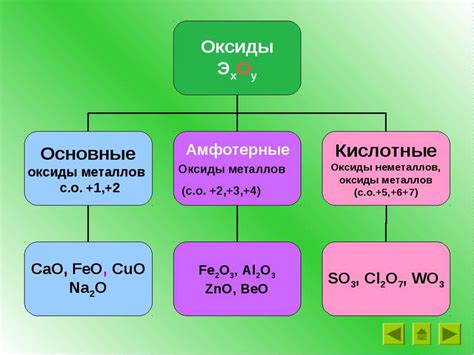
Один из методов определения амфотерного оксида в химии заключается в исследовании его реакции с щелочной средой. В результате такой реакции происходит образование соли и воды, а также можно наблюдать изменение окраски раствора. Этот метод основан на способности амфотерных оксидов проявлять кислотные или щелочные свойства в зависимости от условий.
Возьмем в качестве примера амфотерный оксид - оксид алюминия (Al2O3). При реакции данного оксида с щелочью (например, NaOH) происходит образование натрий-алюминиевого гидроксида (NaAlO2) и вода. Реакция можно представить следующим образом:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
При проведении данной реакции можно наблюдать изменение окраски раствора сначала на белый, а затем на бесцветный, что указывает на образование натрий-алюминиевого гидроксида.
Таким образом, реакция амфотерного оксида с щелочью является одним из методов определения таких оксидов. Образование соли и воды, а также изменение окраски раствора при направленной реакции может служить показателем амфотерности оксида. Этот метод широко применяется в химических исследованиях и анализе веществ.
Амфотерные оксиды: примеры и реакции
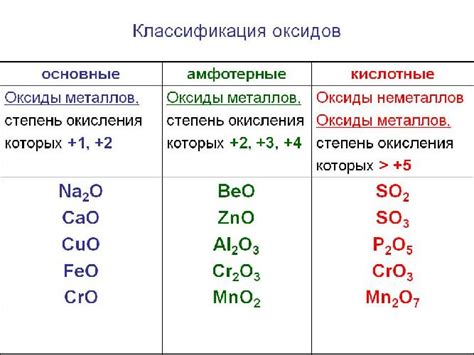
В данном разделе мы рассмотрим несколько примеров амфотерных оксидов и изучим их реакции с различными реагентами. Амфотерные оксиды представляют собой соединения, способные проявлять как кислотные, так и основные свойства в зависимости от условий реакции и реагентов, с которыми они взаимодействуют.
Один из примеров амфотерного оксида - оксид алюминия (Al2O3). При реакции с кислотами, этот оксид выступает в роли основания, образуя соли и выделяя воду. Например, соляная кислота реагирует с оксидом алюминия:
- Al2O3 + 6HCl → 2AlCl3 + 3H2O
Однако, при взаимодействии с щелочами, оксид алюминия ведет себя как кислота, образуя соли и выделяя воду. Например, реакция с гидроксидом натрия:
- Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
Еще одним примером амфотерного оксида является оксид цинка (ZnO). Он способен реагировать и с кислотами, и с щелочами. Например, реакция с соляной кислотой:
- ZnO + 2HCl → ZnCl2 + H2O
Также оксид цинка может взаимодействовать с гидроксидом натрия:
- ZnO + 2NaOH → Na2ZnO2 + H2O
Приведенные примеры демонстрируют амфотерные свойства указанных оксидов и их способность проявлять кислотные или основные характеристики в зависимости от реагирующих веществ. Изучение таких реакций позволяет более полно понять и классифицировать амфотерные оксиды.
Вопрос-ответ

Что такое амфотерный оксид в химии?
Амфотерный оксид в химии - это химическое вещество, которое может проявлять как кислотные, так и щелочные свойства. Он способен реагировать как с кислотами, так и с основаниями.
Какие методы можно использовать для определения амфотерного оксида в химии?
Для определения амфотерного оксида в химии можно использовать несколько методов. Один из них - определение реактивом образования кислотного оксида или основного оксида в результате взаимодействия с кислотным или щелочным раствором. Другим методом является реакция с индикаторами, которые меняют свой цвет в зависимости от pH окружающей среды. Также можно провести реакцию с известным кислотным и щелочным растворами для определения свойств амфотерного оксида.
Можете привести примеры амфотерных оксидов?
Конечно! Примеры амфотерных оксидов включают оксиды алюминия (Al2O3) и цинка (ZnO). Эти вещества могут реагировать как с кислотами, так и с щелочами, образуя соответствующие соли (алюминаты и цинкаты).